THNO2/KOH=2.00mg/mL THNO2/KMnO4=3.00mg/mL 欲配制500mL
THNO2/KOH=2.00mg/mL,THNO2/KMnO4=3.00mg/mL,欲配制500mL上述溶液,问各需称取药品多少克?
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:(1)反应:HNO2+KOH=====KN02+H2O [MKOH=56.11MKMnO4=1 58.03MHNO2=47.00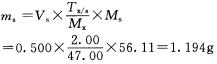 (2)反应:5HN02+2KMnO4+6HCl=====5HN03+2MnCl2+3H2O+2KCln(HN02):n(KMn04)=5:2
(2)反应:5HN02+2KMnO4+6HCl=====5HN03+2MnCl2+3H2O+2KCln(HN02):n(KMn04)=5:2
本题考查滴定度的概念。
相似问题
设初值问题用两步Adams方法解初值问题 取h=0.2计算其数值解。用两步Adams方法解初值问题
设初值问题用两步Adams方法解初值问题 取h=0.2计算其数值解。用两步Adams方法解初值问题 取h=0.2计算其数值解。请帮忙给出正确答案和分析,谢谢!
用Newton法求方程f(χ)=χ3+2χ2+10χ-20=0在(1 2)内的一个根。请帮忙给出正确
用Newton法求方程f(χ)=χ3+2χ2+10χ-20=0在(1,2)内的一个根。请帮忙给出正确答案和分析,谢谢!
酸碱滴定中被测物与滴定剂浓度各变化10倍 突跃范围的变化是( )。A.增加一个pH单位B.增加2个p
酸碱滴定中被测物与滴定剂浓度各变化10倍,突跃范围的变化是( )。A.增加一个pH单位B.增加2个pH单位C.2个pH单位D.减小2个pH单位请帮忙给出正确答案和
设自由落体算式S=gt2 假定重力加速度g是准确的 而时间t的测量有±0.1秒的误差。证明:当时间t
设自由落体算式S=gt2,假定重力加速度g是准确的,而时间t的测量有±0.1秒的误差。证明:当时间t增大时,计算距离s的绝对误差增加,而相对误差却减小。
取工业废水水样10.00mL两份 用0.1000mol/L HCl溶液滴定。其中一份以百里酚蓝一甲基
取工业废水水样10.00mL两份,用0.1000mol/L HCl溶液滴定。其中一份以百里酚蓝一甲基红混合指示剂(即pH=8.3指示剂)滴定至黄色时,消耗13.26mL,用












