向1 L pH=2的盐酸和醋酸溶液中 分别投入0.65 g锌粒 则下图中比较符合客观事实的是
向1 L pH=2的盐酸和醋酸溶液中,分别投入0.65 g锌粒,则下图中比较符合客观事实的是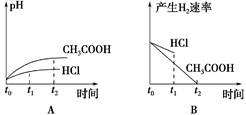 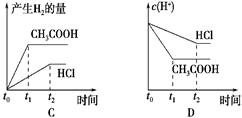 |
参考解答
| C |
| 0.65 g锌粒是0.01mol,盐酸是强酸,起物质的量是0.01mol,所以盐酸不足,生成氢气是0.005mol。醋酸是弱酸,其浓度大于0.01mol/L,所以锌不足,即醋酸产生的氢气多。由于在反应过程中,产生会继续电离出氢离子,所以醋酸的反应速率快,答案选C。 |
相似问题
下列事实不能证明HN02是弱电解质的是( )①滴入酚酞 NaN02溶液显红色②用HN02溶液做
下列事实不能证明HN02是弱电解质的是( )①滴入酚酞,NaN02溶液显红色②用HN02溶液做导电实验,灯泡很暗③等pH、等体积的盐酸和HN02溶液中和碱时,HNO2的
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH≒CH3COO-+H+
在0 1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH≒CH3COO-+H+对于该平衡,下列叙述正确的是A.加入水时,平衡向电离方向移动,pH减小B.加
有甲 乙两瓶醋酸稀溶液 测得甲的pH=a 乙的pH=a+1.下列推断正确的是 ( )A
有甲、乙两瓶醋酸稀溶液,测得甲的pH=a,乙的pH=a+1.下列推断正确的是()A.物质的量浓度c(甲)是c(乙)的10倍B.溶液中的c(OH-)甲是乙的10倍C.由
常温下 向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物
常温下,向20mL 0 2mol L H2A溶液中滴加0 2 mol L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaO
浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液 ②氢氧化钠溶液 ③醋酸
浓度均为0 1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是A.①和②等体积混合后的溶液中:c(OH-)=c(H+)












