常温下 向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是( )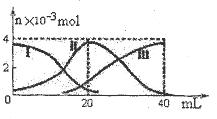
|
参考解答
| A |
| 当V(NaOH)=20mL时,H2A与NaOH刚好反应生成4x10-3 mol NaHA,根据图知HA- 的物质的量略小于4x10-3 mol,知c (Na+)>c(HA-),而A2-的物质的量略小于10-3 mol, H2A不为0,表明HA-少量电离(c(HA-)>c(H+)),少量发生水解,又A2-的量大于H2A的量, 则HA-的电离程度大于水解程度,HA-可电离出H+、A2-,而水电离出 H+及 OH-,所以 c(H+)>c(A2-),c(H+)>c(OH-),溶液显酸性,c(A2-)>c(OH-)(A2-的物质的量略小于10-3 mol), 滴加过程中当溶液呈中性时,V(NaOH)>20mL所以A正确,B错,C错;当V(NaOH)=40mL 时,H2A与NaOH刚好反应生成4x10-3 mol Na2A,由图知A2-略水解,溶液略呈碱性,向所得 溶液加水稀释的过程中虽促进了A2-的水解但c(OH-)减小,pH减小,D错。 |
相似问题
浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液 ②氢氧化钠溶液 ③醋酸
浓度均为0 1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是A.①和②等体积混合后的溶液中:c(OH-)=c(H+)
要使0.1mol/L CH3COOH溶液中CH3COOH的电离程度减小 同时又使CH3COO-浓度增
要使0 1mol L CH3COOH溶液中CH3COOH的电离程度减小,同时又使CH3COO-浓度增大;可加入的试剂是A.CH3COONa晶体B.氨水C.0 1mol L H2SO4溶液D.0 01mol L CH3COOH溶液
常温下将体积都为10mL pH都等于3的醋酸和盐酸 加水稀释至a mL和b mL 测得稀释后溶液的p
常温下将体积都为10mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积为()A.a>bB.a<bC.a= "b=100mL " D.a=b=100mL
下列电离方程式中 书写正确的是 ( )A.Cu(OH)2=Cu2+ + 2 OH-B.NH3
下列电离方程式中,书写正确的是 ( )A.Cu(OH)2=Cu2+ + 2 OH-B.NH3·H2ONH4+ + OH-C.HF= H+ + F-D.H3PO43 H+ + PO43-
现有0.1mol·L-1的下面所列溶液:①醋酸溶液 ②NH3·H2O溶液 ③稀H2SO4 ④稀盐酸溶
现有0 1mol·L-1的下面所列溶液:①醋酸溶液 ②NH3·H2O溶液 ③稀H2SO4④稀盐酸溶液⑤NaOH溶液,按溶液中c(H+)由大到小排列正确的是()A.①③②④⑤B












