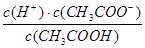在25℃时 用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L 随溶液的稀释 下列各项中始终
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是 ( )
|
参考解答
| A |
试题分析:醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,但c(OH-)增大,据此分析解答。 A中加水稀释醋酸,促进醋酸电离,n(H+)增大,n(CH3COOH)减小,所以  增大,正确; 增大,正确;B中加水稀释醋酸,促进醋酸电离,n(H+)增大,n(CH3COOH)减小,所以 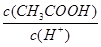 减小,B不正确; 减小,B不正确;C中加水稀释醋酸,促进醋酸电离,n(CH3COOH)减小,n(CH3COO-)增大,则 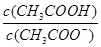 减小,C不正确; 减小,C不正确;D中温度不变,醋酸的电离平衡常数不变,故D错误,答案选A。 点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,基础性强,有利于培养学生的逻辑思维能力和抽象思维能力。注意电离平衡常数只与温度有关,与溶液的浓度无关,D为易错点 |
相似问题
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:回答下列问题:(1)物质的量浓度均为0.1 m
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:回答下列问题:(1)物质的量浓度均为0 1 mol·L-1的四种溶液:a CH3COONab Na2CO3c NaClOd NaHCO3
现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸 ②硫酸 ③醋酸 ④NaO
现有溶液中溶质的物质的量浓度均为0 01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是()A.pH由小到大的顺序是①< ②<
部分弱酸的电离平衡常数如下表:弱酸H2CO3H2SO3HClO电离平衡常数(25℃)K1=4.30×
部分弱酸的电离平衡常数如下表:弱酸H2CO3H2SO3HClO电离平衡常数(25℃)K1=4 30×l0-7K1=1 54×l0-2K=2 95×l0-8K2=5 61×l0-11K2=1 02×l0-7下列离子反
下列溶液中导电性最强的是( )A.醋酸B.溶液C.盐酸D.溶液
下列溶液中导电性最强的是()A.醋酸B.溶液C.盐酸D.溶液
化合物HIn在水溶液中因存在以下电离平衡 故可用作酸碱指示剂HIn(溶液) H+(溶液)+In-(溶
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂HIn(溶液) H+(溶液)+In-(溶液)红色黄色浓度为0 02 mol·L-1的下列各溶液:①盐酸②石