已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:回答下列问题:(1)物质的量浓度均为0.1 m
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示: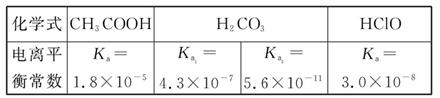 回答下列问题: (1)物质的量浓度均为0.1 mol·L-1的四种溶液: a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 pH由小到大排列顺序是 (用编号填写)。 (2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。 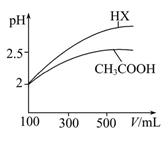 |
参考解答
| (1)a<d<c<b (2)B、D (3)大于 稀释相同倍数,一元酸HX的pH变化比CH3COOH的pH变化大,故HX酸性较强,电离平衡常数较大 |
| (1)根据表中的电离平衡常数,可知酸性:CH3COOH>H2CO3>HClO>HCO3- 因此对应钠盐溶液的碱性: CH3COONa<NaHCO3<NaClO<Na2CO3。 (2)CH3COOH加水稀释,电离程度增大,n(H+)增大,但c(H+)减小,A错;由于温度不变,电离平衡常数不变,水的离子积不变,C错、E错;c(H+)/c(CH3COOH)= Ka/c(CH3COO-),因此c(H+)/c(CH3COOH)增大,B对;c(H+)减小,而水的离子积不变,则c(OH-)增大,因此c(OH-)/c(H+)增大,D对。 |
相似问题
现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸 ②硫酸 ③醋酸 ④NaO
现有溶液中溶质的物质的量浓度均为0 01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是()A.pH由小到大的顺序是①< ②<
部分弱酸的电离平衡常数如下表:弱酸H2CO3H2SO3HClO电离平衡常数(25℃)K1=4.30×
部分弱酸的电离平衡常数如下表:弱酸H2CO3H2SO3HClO电离平衡常数(25℃)K1=4 30×l0-7K1=1 54×l0-2K=2 95×l0-8K2=5 61×l0-11K2=1 02×l0-7下列离子反
下列溶液中导电性最强的是( )A.醋酸B.溶液C.盐酸D.溶液
下列溶液中导电性最强的是()A.醋酸B.溶液C.盐酸D.溶液
化合物HIn在水溶液中因存在以下电离平衡 故可用作酸碱指示剂HIn(溶液) H+(溶液)+In-(溶
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂HIn(溶液) H+(溶液)+In-(溶液)红色黄色浓度为0 02 mol·L-1的下列各溶液:①盐酸②石
下列事实一定能证明HNO2是弱电解质的是( )①常温下NaNO2溶液的pH大于7②用HNO2溶液做
下列事实一定能证明HNO2是弱电解质的是( )①常温下NaNO2溶液的pH大于7②用HNO2溶液做导电实验,灯泡很暗③HNO2和NaCl不能发生反应④常温下0.1 mol·












