(17分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物 极易与空气中水蒸汽和CO2反应
| (17分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究: (1)【猜想】 猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH; 猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。 (2)【实验】如下图所示: 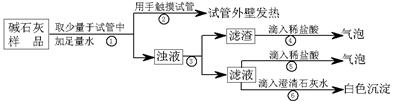 a、CaO与水反应的反应方程式为 。 b、操作③中玻璃棒的作用是 。 c、操作④发生化学反应的离子方程式为 ; (3)【判断】 a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立) b.由操作⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。 c.综合a和b的结论,判断该样品变质情况为 。 |
参考解答
(2)a. CaO+H2O==Ca(OH)2(3分) b. 引流,防止溶液外溅(3分) c. CaCO3+2H+ ==Ca2++CO2↑+H2O(3分) (3)a.不成立(2分) b. Na2CO3(2分) 不成立(2分) c. 部分变质(2分) |
| 略 |
相似问题
(14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸 滴定结果如图所示。回答
(14分)用一定物质的量浓度的NaOH溶液滴定10 00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:(1)有关滴定的操作可分解为如下几步,并补充完
(1) 实验过程中 可能观察到的主要现象有:①
(1) 实验过程中,可能观察到的主要现象有:①;②;③;④;(2) 用该装置做铜与浓硝酸反应的实验,最突出的优点是。(3) 若要验证最终得到的气体生成物
(10分)现有X Y Z三种非金属元素 A B C三种金属元素 已知有如下情况:(1)X Y Z的单
(10分)现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:(1)X、Y、Z的单质在常温下均为气体(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响 并测定(NH4)2S2O8和KI反应的化
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:【实验原理】(NH4)2S2O8和KI反
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“












