(14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸 滴定结果如图所示。回答
(14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题: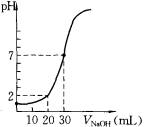 (1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③ ④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。 (2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果 (填“偏高”“偏低”或“不变”)。  (3)如用酚酞作指示剂,则滴定终点的实验现象是 。 (4)c(HCl)= mol·L-1 (5)c(NaOH) = mol·L-1 (6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号) 。
|
参考解答
| (1)调节滴定管尖嘴使之充满溶液(2)偏低 (3)最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去 (4)0.09 (5)0.03 (6)D (7)9 |
| (1)碱式滴定管在装入标准液后需要调节滴定管尖嘴使之充满溶液。 (2)滴定管自上而下刻度线是逐渐增大的,所以滴定前俯视滴定管读数,读数是偏小的,则企氢氧化钠的体积偏大,结果就偏低。 (3)由于是氢氧化钠滴定盐酸,所以终点时的现象是最后一滴滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去。 (4)根据图像可知,当加入2ml氢氧化钠时,溶液的pH是1。终点时消耗氢氧化钠的体积是30mol,所以盐酸的浓度是氢氧化钠的3倍,则 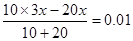 ,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。 ,解得x=0.03mol/L,所以盐酸的浓度是0.09mol/L。(5)见(4) (6)由于滴定管的最下端是不带刻度线的,所以滴定管中溶液的体积应大于(50-a)mL。 (7)一滴硫酸中氢离子的物质的量是0.05 ml×10-3×2×0.01 mol/L=10-6mol/L,所以过量的氢氧化钠是10-6mol/L,因此c(OH-)= 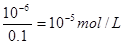 ,则氢离子浓度是10-9mol/L,pH等于9. ,则氢离子浓度是10-9mol/L,pH等于9. |
相似问题
(1) 实验过程中 可能观察到的主要现象有:①
(1) 实验过程中,可能观察到的主要现象有:①;②;③;④;(2) 用该装置做铜与浓硝酸反应的实验,最突出的优点是。(3) 若要验证最终得到的气体生成物
(10分)现有X Y Z三种非金属元素 A B C三种金属元素 已知有如下情况:(1)X Y Z的单
(10分)现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:(1)X、Y、Z的单质在常温下均为气体(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响 并测定(NH4)2S2O8和KI反应的化
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:【实验原理】(NH4)2S2O8和KI反
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“
(14分)某实验小组同学为了探究铜与浓硫酸的反应 进行了如下系列实验。[实验1]铜与浓硫酸反应 实验
(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。[实验1]铜与浓硫酸反应,实验装置如图所示。实验步骤:①先连接好装置,检验气密












