(13分)I.某校化学实验小组探究浓度对化学反应速率的影响 并测定(NH4)2S2O8和KI反应的化
| (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究: 【实验原理】 (NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2 (1) 平均反应速率的计算式为v(S2O82-)= 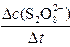 。 。实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。 在反应(1)进行的同时,发生反应:2S2O32-+ I2 =" " S4O62-+ 2I- (2) 反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。 【实验内容】 (1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。 (4)根据上表数据分析,可以得到的结论有(写出一条即可) 。 II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓; Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。 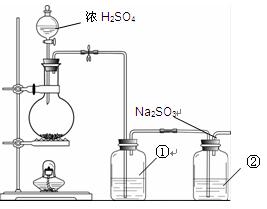 (1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是 ① ; ② 。 (2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。 (3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考解答
| (13分) I(1)a 8.0 (1分) b 5.0 (1分) c 15.0 (1分) (2)搅拌 (1分) (3)2.5 × 10-5 (2分)(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等(只答浓度对化学反应速率有影响不给分) (1分) II(1)①Na2S溶液、Na2CO3溶液(2分)②NaOH溶液…(不写溶液不得分)(1分) (2)沉淀逐渐消失 (1分) (3)加热浓缩,冷却结晶,过滤(2分) |
| 略 |
相似问题
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述
(10分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“
(14分)某实验小组同学为了探究铜与浓硫酸的反应 进行了如下系列实验。[实验1]铜与浓硫酸反应 实验
(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。[实验1]铜与浓硫酸反应,实验装置如图所示。实验步骤:①先连接好装置,检验气密
下列关于实验原理或操作的叙述中 正确的是
下列关于实验原理或操作的叙述中,正确的是()A.用无水乙醇从碘水中提取单质碘B.稀释浓硫酸时,应将浓硫酸缓缓注入盛有水的量筒中C.配制.FeCl3溶液
(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中
(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。(1)提出问题
某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg/m3)进行测定。分光光度法则是通过测定
某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg m3)进行测定。分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性












