理论上 SO2能发生类似CO2与澄清石灰水作用的反应 但在通常实验中 将SO2通入澄清石灰水却没有看
理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象.针对这一问题,研究性学习小组开展了探究性实验.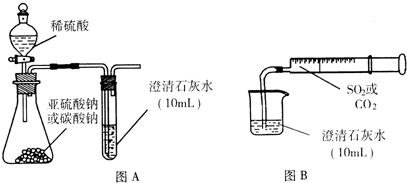 I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通入CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象. Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象.当以相同速率分别通入CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快. 回答下列问题: (1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通入澄清石灰水,依次发生的反应有:(用离子方程式表示)______;______. (2)实验I中,通入SO2不能出现浑浊的原因可能是:______. (3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有______. ①SO2在水中溶解度比CO2大. ②相同状态下,SO2的密度比CO2的密度大. ③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度. ④SO2有毒和刺激性气味,CO2无毒和无刺激性气味. ⑤相同条件下,1mol SO2与足量石灰水反应生成CaSO3的速率大于1mol CO2与足量石灰水反应生成CaCO3的速率. ⑥相同条件下,1molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率. |
参考解答
| (1)二氧化碳与氢氧化钙溶液反应生成碳酸钙和水、碳酸钙与水与二氧化碳反应生成碳酸氢钙,而SO2和CO2均属于非金属氧化物,某些性质相似,因此二氧化硫通入澄清石灰水生成亚硫酸钙沉淀和水,反应的化学方程式为SO2+Ca(OH)2═CaSO3↓+H2O,继续通沉淀溶解反应方程式为:CaSO3+H2O+SO2=Ca(HSO3)2,所以离子反应方程式为SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-, 故答案为:SO2+Ca2++2OH-═CaSO3↓+H2O;CaSO3+H2O+SO2=Ca2++2HSO3-; (2)二氧化硫与澄清的石灰水反应,如果二氧化硫过量,会发生CaSO3+H2O+SO2=Ca(HSO3)2,亚硫酸氢钙易溶于水,所以,当实验操作通入二氧化硫较快较多,澄清的石灰水相对比较少,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀, 故答案为:澄清的石灰水比较少,通入二氧化硫较快较多,两者反应时直接生成了易溶于水的酸式盐,而看不到沉淀; (3)①1体积水中溶解二氧化硫为40体积,1体积水中溶解二氧化碳为2体积,所以,SO2在水中溶解度比CO2大,在溶液中,参加反应的二氧化硫比二氧化碳多,故①正确; ②密度大小与在溶液中的气体的物质的量的多少无关,所以相同状态下,SO2的密度比CO2的密度大与反应现象无关,故②错误; ③二氧化硫与水反应生成亚硫酸,二氧化碳与水反应生成碳酸,亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度,与碱反应,前者电离出的氢离子多,反应快,故③正确; ④二氧化硫气体与二氧化碳的气体与碱反应,本质为酸性气体和碱反应,其气味和毒性与碱反应快慢无关,故④错误; ⑤相同条件下,相同的物质的量与碱反应,反应快,能说明SO2产生现象比CO2快,所以,1mol SO2与足量石灰水反应生成CaSO3的速率大于1mol CO2与足量石灰水反应生成CaCO3的速率正确,故⑤正确; ⑥相同条件下,相同的物质的量的气体与沉淀,溶解得快,说明SO2产生现象比CO2快,所以,1molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率,正确,故⑥正确; 故答案为:①③⑤⑥. |
相似问题
无水亚硫酸钠隔绝空气加热到600℃便开始分解 分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装
某种牙膏中的摩擦剂是碳酸钙 可以用石灰石(含杂质SiO2)来制备.某同学甲设计了一种制备碳酸钙的方案
某种牙膏中的摩擦剂是碳酸钙,可以用石灰石(含杂质SiO2)来制备.某同学甲设计了一种制备碳酸钙的方案,其流程图为:请回答下列问题:(1)假设第①步反
断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )A.加热观察是否有气体放出B.加盐酸并
断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )A.加热观察是否有气体放出B.加盐酸并观察生成气体的速度C.Ba(OH)2溶液,观察有无白色沉淀生成D
化学实验室中常将溶液或试剂进行酸化 下列酸化处理中正确的是( )A.检验C2H5Cl中Cl元素时
化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是( )A.检验C2H5Cl中Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化B.鉴别溶液
下列有关物质分离 提纯方案正确的是( )A.除去铁粉中混有的I2:加热使I2升华B.除去NaCl固
下列有关物质分离、提纯方案正确的是( )A.除去铁粉中混有的I2:加热使I2升华B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶C.除












