无水亚硫酸钠隔绝空气加热到600℃便开始分解 分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受
| 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O) (1)无水亚硫酸钠受热分解的化学方程式是______,装置中的NaOH溶液的作用是______. (2)如果加热温度在600℃以上,再向所得固体的试样溶液中缓缓滴加稀盐酸至足量,观察到CuSO4溶液中出现黑色沉淀,试分析其他装置中可能出现的现象.试样溶液:______,解释这种现象的离子方程式是______;品红溶液:______,出现这种现象的原因是:______. (3)若加入了足量的稀盐酸后,品红溶液和CuSO4溶液中仍无明显的现象发生,原因是______. 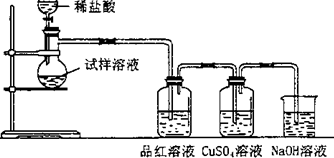 |
参考解答
| (1)亚硫酸钠在600℃以上可分解,这在中学化学中未介绍,但根据题示信息可推出分解产物.根据“Na2SO3分解生成Na2S+另一种固体”,可从硫元素化合价变化进行推理分析,另一种固体中硫元素的化合价应高于+4价,所以这种固体是Na2SO4,解的化学方程式是4Na2SO3=Na2S+3Na2SO4;从中可得出,装置中会产生SO2、H2S等气体,考虑到这些气体都不能直接排放到空气中,所以氢氧化钠溶液的作用是吸收SO2或H2S,故答案为:4Na2SO3=Na2S+3Na2SO4;吸收H2S或SO2气体; (2)温度高于600℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫.根据“硫酸铜中出现黑色沉淀”可得出,烧瓶中没有SO2放出.所以试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出.SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑.品红溶液不裉色;因为加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比小于1:2,在酸性溶液中反应,Na2S过量,产生气体只含H2S,不含SO2,故答案为:有淡黄色沉淀生成,并有气泡冒出;SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;有气泡生成但不褪色;加热后固体中所含的Na2SO3和Na2S的物质的量之比小于1:2,在酸性溶液中反应产生的气体只含H2S,而不含SO2; (3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S,进而可推出,加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比恰好等于1:2,在酸性溶液中两者恰好完全反应,不产生H2S和SO2, 故答案为:加热后固体中所含Na2SO3和Na2S的物质的量之比等于1:2,在酸性溶液中恰好生成S,不产生H2S和SO2. |
相似问题
某种牙膏中的摩擦剂是碳酸钙 可以用石灰石(含杂质SiO2)来制备.某同学甲设计了一种制备碳酸钙的方案
某种牙膏中的摩擦剂是碳酸钙,可以用石灰石(含杂质SiO2)来制备.某同学甲设计了一种制备碳酸钙的方案,其流程图为:请回答下列问题:(1)假设第①步反
断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )A.加热观察是否有气体放出B.加盐酸并
断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )A.加热观察是否有气体放出B.加盐酸并观察生成气体的速度C.Ba(OH)2溶液,观察有无白色沉淀生成D
化学实验室中常将溶液或试剂进行酸化 下列酸化处理中正确的是( )A.检验C2H5Cl中Cl元素时
化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是( )A.检验C2H5Cl中Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化B.鉴别溶液
下列有关物质分离 提纯方案正确的是( )A.除去铁粉中混有的I2:加热使I2升华B.除去NaCl固
下列有关物质分离、提纯方案正确的是( )A.除去铁粉中混有的I2:加热使I2升华B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶C.除
限用下列一种试剂鉴别氯化钠 氯化铝 氯化亚铁 氯化铁 氯化镁五种溶液 这种试剂是( )A.KSCN
限用下列一种试剂鉴别氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,这种试剂是( )A.KSCNB.HClC.BaCl2D.NaOH












