在稀硫酸与锌反应制取氢气的实验中 探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是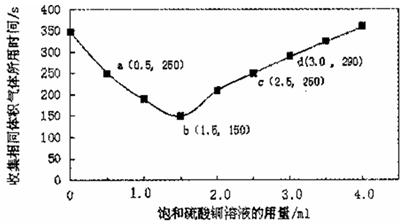
|
参考解答
| D |
试题分析:A、根据图像可知随着饱和硫酸铜的增加,收集相同体积的气体所需时间先逐渐减少,然后又逐渐增加,因此饱和硫酸铜溶液用量过多不利于更快收集氢气,A正确;B、根据图像可知a ,c两点对应的时间都是250s,所以氢气生成速率相等,B正确;C、b点对应的时间是150s,生成氢气的物质的量是0.336L÷22.4L/mol=0.015mol,消耗稀硫酸的物质的量是0.015mol,其浓度是0.015mol÷0.1L=0.15mol/L,所以反应速率为v( H2SO4)=0.15mol/L÷150s=1.0x10-3mol·L -1 ·s-1,C正确;D、d点锌也与硫酸铜溶液反应生成铜从而构成原电池,D不正确,答案选D。 |
相似问题
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1) 在标准状
加入0 1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1 1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。(1)A、B、C、
在容积为2.0 L的密闭容器内 物质D在T℃时发生反应 其反应物和生成物的物质的量随时间t的变化关系
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是 ( )A.从反应开始到第一
在一密闭容器中充入一定量的H2和N2 经测定反应开始后3 s末的v(H2)='0.3' mol·L-
在一密闭容器中充入一定量的H2和N2,经测定反应开始后3 s末的v(H2)= "0 3 " mol·L-1·s-1,则3 s末NH3的浓度为( )。A.0 4 mol·L-1B.0 6 mol·L-1C.0 9 mol·L-1D.1 2 mol·L-1
碳和碳的化合物广泛的存在于我们的生活中。(1)根据下列反应的能量变化示意图 2C(s)+O2(g)
碳和碳的化合物广泛的存在于我们的生活中。(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g)△H= 。(2)在体积为2L的密闭容器中,充人1 mol
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。(
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92 60 kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法












