碳和碳的化合物广泛的存在于我们的生活中。(1)根据下列反应的能量变化示意图 2C(s)+O2(g)
| 碳和碳的化合物广泛的存在于我们的生活中。 (1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。 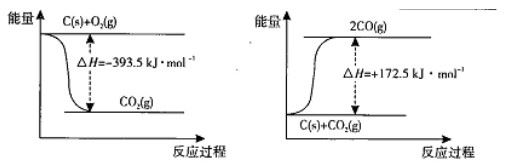 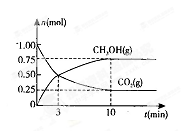 (2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定 条件下发生反应: CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H CH3OH(g)+H2O(g) △H测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示: ①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。 ②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。 A.升高温度 B.将CH3OH(g)及时液化移出 C.选择高效催化剂 D.再充入l mol CO2和4 mol H2 (3) CO2溶于水生成碳酸。已知下列数据:
CO32-第一步水解的平衡常数Kh=Kw/Ka2。 ①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中CO32- 发生第一步水解的离子方程式 。 ②下列粒子之间的关系式,其中正确的是 。 A.c(NH4+)>c(HCO3-)> c(CO32-)>(NH4+) B.c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-) C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L D. c(NH4+)+ c(NH3.H2O)="2" c(CO32-)+ 2c(HCO3-) +2c(H2CO3) (4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特 殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。 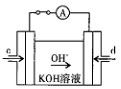 |
参考解答
| (1)-221.0kJ/mol (2) ①0.037mol/L.min ②BD (3) ①碱性 CO32-+H2O  HCO3-+OH- ②CD HCO3-+OH- ②CD(4)CO-2e-+4OH-=CO32-+2H2O |
| (1)根据能量变化图确定, C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,C(s)+CO2(g)='2CO(g)' △H=-172.5kJ/mol 由盖斯定律得, 2C(s)+O2(g) =2CO(g) △H=-221.0kJ/mol。 (3)结合碳酸的Ka1,一水合氨的Kb知,该溶液显碱性,根据电荷元素守恒, 选C、D。 (4)根据原电池原理,结合溶液的碱性得,(4)CO-2e-+4OH-=CO32-+2H2O |
相似问题
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。(
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92 60 kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法
在2 L密闭容器中 800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中 n(NO)随时间
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:时间(s)012345n(NO) mol0 0200 0100 0080 0070 0070 007(1)
某温度下 在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g) 2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5 00 mol L
一定条件下 在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应过程如图:下列说法正确的是A.t1min时正、逆反应速率相等B.X曲
反应3A(g)+B(g)2C(g)+2D(g) 在不同条件下的反应速率分别为:①VA=0.6mol·
反应3A(g)+B(g)2C(g)+2D(g),在不同条件下的反应速率分别为:①VA=0 6mol·L-1·s-1,②VB=0 45mol·L-1·s-1,③VC=0 4mol·L-1·s-1,④VD=0 45mol·L-












