加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1) 在标准状
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。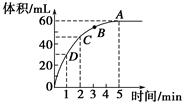 (1)A、B、C、D四点化学反应速率快慢的顺序为____________________。 (2)解释反应速率变化的原因__________________________________。 (3)计算过氧化氢的初始物质的量浓度________。 (4)求反应进行到2分钟时过氧化氢的质量分数。 |
参考解答
| (1)D>C>B>A (2)随着反应的进行,过氧化氢溶液的浓度越来越小,反应速率越来越小 (3)0.107 mol·L-1 (4)0.083% |
| (1)曲线斜率越大,反应速率越大。 (2)随着反应的进行,反应物H2O2的浓度逐渐减小,因此反应速率逐渐减小。 (3)根据图像可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2 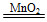 2H2O+O2↑,则 2H2O+O2↑,则n(H2O2)= 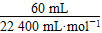 ×2≈0.005 36 mol, ×2≈0.005 36 mol,c(H2O2)= 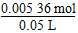 ≈0.107 mol·L-1。 ≈0.107 mol·L-1。(4)反应进行到2分钟时,放出O2 45 mL,则反应生成O2的物质的量为 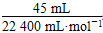 ≈0.002 01 mol, ≈0.002 01 mol,质量为0.002 01 mol×32 g·mol-1≈0.064 3 g 反应消耗的H2O2物质的量为 0.002 01 mol×2=0.004 02 mol, 0.005 36 mol-0.004 02 mol=0.001 34 mol, 则2分钟时H2O2的质量分数为 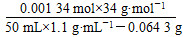 ×100%≈0.083%。 ×100%≈0.083%。 |
相似问题
在容积为2.0 L的密闭容器内 物质D在T℃时发生反应 其反应物和生成物的物质的量随时间t的变化关系
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是 ( )A.从反应开始到第一
在一密闭容器中充入一定量的H2和N2 经测定反应开始后3 s末的v(H2)='0.3' mol·L-
在一密闭容器中充入一定量的H2和N2,经测定反应开始后3 s末的v(H2)= "0 3 " mol·L-1·s-1,则3 s末NH3的浓度为( )。A.0 4 mol·L-1B.0 6 mol·L-1C.0 9 mol·L-1D.1 2 mol·L-1
碳和碳的化合物广泛的存在于我们的生活中。(1)根据下列反应的能量变化示意图 2C(s)+O2(g)
碳和碳的化合物广泛的存在于我们的生活中。(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g)△H= 。(2)在体积为2L的密闭容器中,充人1 mol
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。(
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92 60 kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法
在2 L密闭容器中 800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中 n(NO)随时间
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:时间(s)012345n(NO) mol0 0200 0100 0080 0070 0070 007(1)












