根据下图 可以由重晶石(BaSO4)作为原料 制造金属钡及一些钡的化合物。试回答下列问题: (1)
根据下图,可以由重晶石(BaSO4)作为原料,制造金属钡及一些钡的化合物。试回答下列问题: 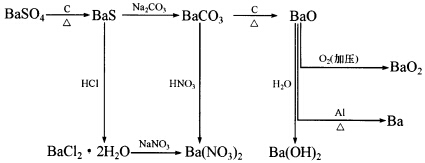 (1)现拟从重晶石制备BaCl2.2H2O。应该采用哪些步骤?写出其化学方程式,并说明完成反应的理由。 (2)为何不能用BaS与硝酸作用直接制备Ba(NO3)2? (3)为何工业上不采用BaCO3直接加热分解方法制备BaO?
(1)现拟从重晶石制备BaCl2.2H2O。应该采用哪些步骤?写出其化学方程式,并说明完成反应的理由。 (2)为何不能用BaS与硝酸作用直接制备Ba(NO3)2? (3)为何工业上不采用BaCO3直接加热分解方法制备BaO?
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:(1)BaSO4+2C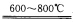 Bas+2CO2↑ C作为还原剂还原BaSO4在较低温度下自身生成CO2: BaS+2HCl+2H2O====BaCl2.2H2O+H2S BaS遇强酸作用生成水合盐与H2S气体气体离开反应体系促使反应完全。 (2)因为BaS中硫有还原性硝酸有氧化性发生氧化还原反应生成硫和氮氧化物不仅多耗硝酸浪费试剂而且污染环境。 (3)Ba2+半径大极化作用小BaCO3分解温度高直接加热将耗费能源成本高用C还原降低反应温度节约成本。
Bas+2CO2↑ C作为还原剂还原BaSO4在较低温度下自身生成CO2: BaS+2HCl+2H2O====BaCl2.2H2O+H2S BaS遇强酸作用生成水合盐与H2S气体气体离开反应体系促使反应完全。 (2)因为BaS中硫有还原性硝酸有氧化性发生氧化还原反应生成硫和氮氧化物不仅多耗硝酸浪费试剂而且污染环境。 (3)Ba2+半径大极化作用小BaCO3分解温度高直接加热将耗费能源成本高用C还原降低反应温度节约成本。
(1)BaSO4+2CBas+2CO2↑C作为还原剂,还原BaSO4,在较低温度下自身生成CO2:BaS+2HCl+2H2O====BaCl2.2H2O+H2SBaS遇强酸作用,生成水合盐与H2S气体,气体离开反应体系,促使反应完全。(2)因为BaS中硫有还原性,硝酸有氧化性,发生氧化还原反应,生成硫和氮氧化物,不仅多耗硝酸浪费试剂,而且污染环境。(3)Ba2+半径大,极化作用小,BaCO3分解温度高,直接加热将耗费能源,成本高,用C还原降低反应温度,节约成本。
相似问题
已知齐次线性方程组 已知齐次线性方程组 (1)判别有无非零解; (2)若有非零解 则求解的一般表已知
已知齐次线性方程组 已知齐次线性方程组 (1)判别有无非零解; (2)若有非零解,则求解的一般表已知齐次线性方程组 (1)判别有无非零解; (2)若有非
求下列矩阵的代数和: 求下列矩阵与矩阵的积:求下列矩阵与矩阵的积: 请帮忙给出正确答案和分析 谢谢!
求下列矩阵的代数和: 求下列矩阵与矩阵的积:求下列矩阵与矩阵的积: 请帮忙给出正确答案和分析,谢谢!
解线性方程组 已知线性方程组 讨论当常数γ为何值时 它有唯一解 有无穷多解或无解.已知线性方程组
解线性方程组 已知线性方程组 讨论当常数γ为何值时,它有唯一解、有无穷多解或无解.已知线性方程组 讨论当常数γ为何值时,它有唯一解、有无穷多
已知二阶方阵求下列矩阵的秩:求下列矩阵的秩: 请帮忙给出正确答案和分析 谢谢!
已知二阶方阵求下列矩阵的秩:求下列矩阵的秩: 请帮忙给出正确答案和分析,谢谢!
已知矩阵已知矩阵 求秩r(AT).已知矩阵 求秩r(AT).请帮忙给出正确答案和分析 谢谢!
已知矩阵已知矩阵 求秩r(AT).已知矩阵 求秩r(AT).请帮忙给出正确答案和分析,谢谢!












