现有pH=2的A B两种酸溶液各1 mL 分别加水稀释到1 L 其pH与溶液体积的关系如图所示 下列
现有pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 L,其pH与溶液体积的关系如图所示,下列说法正确的是( )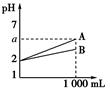 ①A是强酸或比B强的弱酸,B是弱酸 ②稀释后,A溶液的酸性比B溶液强 ③若A、B均为弱酸,则2<a<5 ④若A、B均为强酸,则A、B的物质的量浓度一定相等. A.①② B.①③ C.①③④ D.②③④ |
参考解答
| B |
| 根据图像可知,稀释后B的酸性强于A的,说明在B溶液中存在电离平衡,所以A的酸性强于B的,①正确,②不正确。如果都是弱酸,则稀释1000倍后,其pH都小于5,③正确。④不正确,因为二者一定都是一元强酸或二元强酸等,答案选B。 |
相似问题
已知某温度下 在100 mL浓度为0.01 mol/L的NaHB电解质溶液中 c(H+)>(OH-)
已知某温度下,在100 mL浓度为0 01 mol L的NaHB电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是( )A.溶液的pH="2" B.c(Na+)="0 01" mol L≥
关于电解质的下列说法有正确的是A.电解质在溶液中和熔融状态下都能导电B.NH3的水溶液呈碱性 所以N
关于电解质的下列说法有正确的是A.电解质在溶液中和熔融状态下都能导电B.NH3的水溶液呈碱性,所以NH3是一种强碱C.Na2CO3是电解质,属于盐D.NaCl是电
已知25℃时部分弱电解质的电离平衡常数数据如下表:化学式CH3COOHH2CO3HClO平衡常数Ka
已知25℃时部分弱电解质的电离平衡常数数据如下表:化学式CH3COOHH2CO3HClO平衡常数Ka=1 8×10-5Ka1=4 3×10-7Ka2=5 6×10-11Ka=3 0×10-8回答下列问题:
能证明醋酸是弱酸的事实是( )A.能溶于水B.常温下 0.1 mol·Lˉ1醋酸溶液中的c(H
能证明醋酸是弱酸的事实是( )A.能溶于水B.常温下,0 1 mol·Lˉ1醋酸溶液中的c(H+)为1 32×10-3mol·Lˉ1C.能使紫色石蕊试液变红D.能被弱碱氨水中和
pH=11的x y两种碱溶液各5mL 分别稀释至500mL 其pH与溶液体积(V)的关系如图所示。下
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示。下列说法正确的是( )。A.稀释后x溶液中水的电离程度比y溶液中水












