已知25℃时部分弱电解质的电离平衡常数数据如下表:化学式CH3COOHH2CO3HClO平衡常数Ka
已知25℃时部分弱电解质的电离平衡常数数据如下表:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________ (2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________ (4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________ 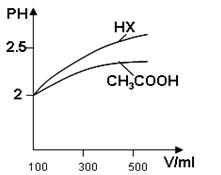 | |||||||||||||||||||
参考解答
| (1)a d c b (2分) (2)BD(2分) (3)大于(2分) 稀释相同倍数,一元 酸HX的PH变化比CH3COOH大,故酸性强,电离平衡常数大。(2分) (4)9.9×10-7(3分) 18(3分) |
| 略 |
相似问题
能证明醋酸是弱酸的事实是( )A.能溶于水B.常温下 0.1 mol·Lˉ1醋酸溶液中的c(H
能证明醋酸是弱酸的事实是( )A.能溶于水B.常温下,0 1 mol·Lˉ1醋酸溶液中的c(H+)为1 32×10-3mol·Lˉ1C.能使紫色石蕊试液变红D.能被弱碱氨水中和
pH=11的x y两种碱溶液各5mL 分别稀释至500mL 其pH与溶液体积(V)的关系如图所示。下
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示。下列说法正确的是( )。A.稀释后x溶液中水的电离程度比y溶液中水
(4分)下列溶液 c(H+)由小到大的排列顺序是 PH由小到大的是
(4分)下列溶液,c(H+)由小到大的排列顺序是,PH由小到大的是。①0 05mol LH2SO4 ② 0 1mol NH3·H2O ③ 0 1mol CH3COOH ④0 05mol Ba(OH)2
(9分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·
(9分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦Fe ⑧金刚石 ⑨Cl2 ⑩澄清石灰水 ?NaOH, 其中属于电解质的有
(4分)简答题(1)盐碱地因含较多的 使得土壤呈碱性 不利于作物生长 通过施加适量石膏粉末(主要含有
(4分)简答题(1)盐碱地因含较多的,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有,微溶于水)来降低土壤的碱性。用离子方程式和












