工业上用氯化铁溶液腐蚀铜制电路板。如下图 横坐标为溶液pH 纵坐标为金属离子的物质的量浓度的对数(当
| 工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题 |
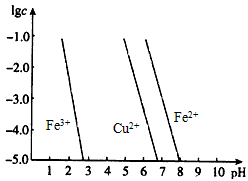 |
| (1)腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/L,今向混合溶液中通入氨气调节溶液的 pH=5.6时,溶液中存在的金属阳离子为_____________。 (2)从图中数据计算可得Fe(OH)2的溶度积:Ksp[Fe(OH)2]=___________。 |
参考解答
| (1)Cu2+、Fe2+ (2)1.0×10-17(mol/L)3 |
相似问题
已知25℃时 电离常数Ka(HF)=3.6×10-4 mol·L-1 溶度积常数KSP(CaF2)=
已知25℃时,电离常数Ka(HF)=3 6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1 46×10-10 mol3·L-3。现向1L 0 2 mol·L-1HF溶液中加入1L 0 2 mo
已知铅蓄电池放电过程可以表示为PbO2 + 2 H2SO4 + Pb='2' PbSO4 + 2H2
已知铅蓄电池放电过程可以表示为PbO2 + 2 H2SO4 + Pb="2" PbSO4 + 2H2O下列关于铅蓄电池的说法正确的是A.Pb为正极,PbO2为负极B.正极电极反应
人造地球卫星用的一种高能电池——银锌电池 该电池的电极反应式为:Zn+2OH- -2e- = ZnO
人造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是()A
如图所示 将铁 铜通过导线相连 置于稀硫酸中.(1)铁片上的现象是______ 电极反应式_____
如图所示,将铁、铜通过导线相连,置于稀硫酸中.(1)铁片上的现象是______,电极反应式______.(2)铜片上的现象是______,电极反应式______.(3)写
随着人们生活质量的不断提高 废电池进行集中处理的问题被提到议事日程 其首要原因是( )。A.利用电
随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( )。A.利用电池外壳的金属材料B.防止电池中汞、镉和铅等金属离子












