在-50℃时 液氨可发生如下电离2NH3NH4++NH2- 两种离子的平衡浓度均为1×10-15mo
在-50℃时,液氨可发生如下电离2NH3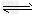 NH4++NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述不正确的是 NH4++NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述不正确的是 |
| [ ] |
| A. 升高温度(仍然为液态),液氨的电离程度变大 B. 在液氨中放入NaNH2,则液氨的离子积数值将增大 C. 在此温度下,液氨的离子积数值为1×10-30 D. 在液氨中放入NH4Cl,则液氨中的c(NH4+)将大于c(NH2-) |
参考解答
| B |
相似问题
在含酚酞的0.1 mol/L氨水中加入少量NH4Cl晶体 则溶液颜色 [ ]A.变蓝色
在含酚酞的0 1 mol L氨水中加入少量NH4Cl晶体,则溶液颜色 [ ]A.变蓝色 B.变深 C.变浅 D.不变
已知某弱酸的酸式盐有NaH2XO4和Na2HXO4 其中NaH2XO4的溶液呈酸性 Na2HXO4溶
已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0 1mol?L-1NaH2XO4溶液和Na2HXO4溶液中均存在的
将0.2 mol/L NaF溶液与0.1mol/L稀硝酸等体积混合后 离子浓度的关系正确的是
将0 2 mol/L NaF溶液与0 1mol/L稀硝酸等体积混合后,离子浓度的关系正确的是
四种酸在25℃的电离平衡常数:①H2CO3:K1=4.30×10-7 ②H3AsO4:K1=6.3×
四种酸在25℃的电离平衡常数:①H2CO3:K1=4 30×10-7 ②H3AsO4:K1=6 3×10-3 ③CH3COOH:K=1 75×10-5④HF:K =3 53×10-4,以下说法正确的是 [
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+ 要使溶液中c(H+
已知0 1mol L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+要使溶液中c(H+) c(CH3COOH)比值增大,可以采取的措施是[ ]A.加少量CH3COONH4固体B.降












