按下图装置进行实验 并回答下列问题(1)判断装置的名称:B池为 (2)铜极为____
按下图装置进行实验,并回答下列问题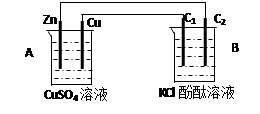 (1)判断装置的名称:B池为 (2)铜极为______极,电极反应式为 石墨棒C2附近发生的实验现象为 (3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少) g. CuSO4溶液的质量变化了(增加或减少了) g . |
参考解答
| (共9分,前3空每空1分,其余各2分) (1) 电解池 (2)正 Cu2+ + 2e- = Cu 有气泡冒出,溶液变红 (3)减少 0.65 增加 0.01 |
试题分析:(1)锌能和硫酸铜发生置换反应,所以根据装置结构特点可知,A是原电池,则B就是电解池。 (2)铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2+ + 2e- = Cu。石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以附近发生的实验现象为有气泡冒出,溶液变红。 (3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。 点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中。主要是考查学生对电化学原理的了解掌握程度,有助于培养学生的逻辑思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。 |
相似问题
在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片 下列叙述正确的是A.正极附近的SO4 2- 离
在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片,下列叙述正确的是A.正极附近的SO4 2- 离子浓度逐渐增大B.铜片上有H2逸出C.溶液的pH逐渐变小D.
镁及其化合物一般无毒(或低毒) 无污染 且镁原电池放电时电压高而平稳 使镁原电池越来越成为人们研制绿
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应
(1)用锌片 铜片连接后浸入稀硫酸溶液中 构成了原电池 工作一段时间 锌片的质量减少了3.25克 铜
(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3 25克,铜表面析出了氢气L(标准状况下)。导线中通过mol电子
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2H2O+2PbSO4 ;镍镉碱性充
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO42H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH- 负极反应
(10分)在铜片 锌片和200 mL稀硫酸组成的原电池中 若电路中通过0.3 mol e— H2SO
(10分)在铜片、锌片和200 mL稀硫酸组成的原电池中,若电路中通过0 3 mol e—,H2SO4恰好作用完毕。试计算:(1)所消耗锌的质量;(2)生成气体的体












