(10分)在铜片 锌片和200 mL稀硫酸组成的原电池中 若电路中通过0.3 mol e— H2SO
| (10分)在铜片、锌片和200 mL稀硫酸组成的原电池中,若电路中通过0.3 mol e—,H2SO4恰好作用完毕。试计算: (1)所消耗锌的质量; (2)生成气体的体积(在标准状况下); (3)原200 mL稀硫酸的物质的量浓度。 |
参考解答
| (1)9.75g (2)3.36L (3)0.75mol/L |
| 考查原电池的有关计算。 (1)锌比铜活泼,所以锌是负极,电极反应式为Zn-2e-=Zn2+ 所以消耗锌是 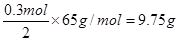 。 。(2)正极是氢离子得到电子,电极反应式为2H++2e-=H2↑ 所以标准状况下氢气的体积是 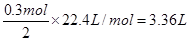 (3)根据氢原子守恒可知,硫酸的浓度是 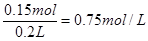 。 。 |
相似问题
蓄电池在放电时起原电池的作用 在充电时起电解池的作用 下式是爱迪生蓄电池分别在充电和放电时发生的反应
蓄电池在放电时起原电池的作用,在充电时起电解池的作用,下式是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2下列有关对
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫 将所得的混合液进行电解循环再生 这种新工艺叫再生循环
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如下
原电池( )A.把光能转化为化学能B.把化学能转化为光能 C.把热能转化为电能D.把化学能转化为
原电池()A.把光能转化为化学能B.把化学能转化为光能 C.把热能转化为电能D.把化学能转化为电能
21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流 新研制的某汽油燃料电池的一个电极通入空气 另
21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,填写下列空格.(1)提练
某原电池总反应是Zn+Cu2+=Zn2++Cu 该原电池组成及判断正确的是 ABCD正极ZnCuZn
某原电池总反应是Zn+Cu2+=Zn2++Cu,该原电池组成及判断正确的是ABCD正极ZnCuZnCu负极CuZnCuZn电解质溶液CuCl2CuCl2ZnCl2ZnCl2












