(1)用锌片 铜片连接后浸入稀硫酸溶液中 构成了原电池 工作一段时间 锌片的质量减少了3.25克 铜
| (1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下)。导线中通过 mol电子。 (2)H、D、T三种原子,在标准状况下,1 mol各单质中,它们的质子数之比是 , (3)含6.02×1023个中子的 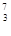 Li的质量是 g。 Li的质量是 g。 |
参考解答
| (1) 1.12 L 2分 0、1 mol 2分 (2)1:1:1 2分 (3)1.75 g 3分 |
(1)考查原电池的有关计算。由于锌的金属性强于铜的,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,电极反应式分别是负极:Zn-2e-=Zn2+、正极:2H++2e-=H2↑。消耗锌是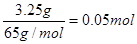 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。 ,转移电子是0.1mol,所以根据电子的得失守恒可知,生成氢气是0.05mol,体积是0.05mol×22.4L/mol=1.12L。(2)H、D、T三种原子互为同位素,所以质子数是相同的,即单质分子中质子数之比是1︰1︰1。 (1)根据 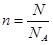 可知,6.02×1023个中子是1mol,又因为 可知,6.02×1023个中子是1mol,又因为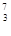 Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。 Li含有4个中子,所以该微粒的物质的量是0.25mol,质量是0.25mol×7g/mol=1.75 g 。 |
相似问题
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2H2O+2PbSO4 ;镍镉碱性充
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO42H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH- 负极反应
(10分)在铜片 锌片和200 mL稀硫酸组成的原电池中 若电路中通过0.3 mol e— H2SO
(10分)在铜片、锌片和200 mL稀硫酸组成的原电池中,若电路中通过0 3 mol e—,H2SO4恰好作用完毕。试计算:(1)所消耗锌的质量;(2)生成气体的体
蓄电池在放电时起原电池的作用 在充电时起电解池的作用 下式是爱迪生蓄电池分别在充电和放电时发生的反应
蓄电池在放电时起原电池的作用,在充电时起电解池的作用,下式是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2下列有关对
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫 将所得的混合液进行电解循环再生 这种新工艺叫再生循环
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如下
原电池( )A.把光能转化为化学能B.把化学能转化为光能 C.把热能转化为电能D.把化学能转化为
原电池()A.把光能转化为化学能B.把化学能转化为光能 C.把热能转化为电能D.把化学能转化为电能












