(14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中 加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题
| (14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ; (2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种); (3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
(第一空填“>”、“<”或“=”;后三空填具体数值) Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。 (5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。 (6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。 |
参考解答
(14分) Ⅱ.(4)否(1分); Ⅱ.(4)否(1分);(5)弱(1分);c(Na+)>c(A-)>c(OH-)>c(H+)(或 [Na+>[A->[OH->[H+)(2分) (6)10-5 (2分); |
(1)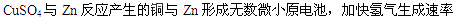 (2)加快化学反应的速率的因素有:升高温度、加入催化剂、增大压强(有气体参加的反应)、增大反应物的浓度、反应物的接触面积大小等,本题可采用的措施有: 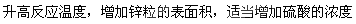 (3)该实验的目的为:研究硫酸铜的量对氢气生成速率的影响,所以所取硫酸的量就是相同的,即V2=V5 =30; 由所加饱和CuSO4溶液的数据分析可得:V6=10;比较D、E、F中饱和CuSO4溶液的体积与所加水的体积分析可知,饱和CuSO4溶液的体积与加入水的体积和为20,进而求得V8=19.5; (4)对于甲组来说,溶液的pH = 7为中性溶液,但无法确定c是否一定等于0.2,HA可以为弱酸,也可以为强酸; (5)由乙组数pH>7,溶液呈碱性,且在等体积混合的情况下,HA的浓度又是NaOH溶液的2倍,即可得HA一定为弱酸。该混合体系中,溶液中的溶质为等物质的量的HA、NaA, 溶液中的离子成分为:Na+、A-、H+、OH-四种成分,由于溶液呈碱性,即以A-水解为主HA电离为次,所以溶液中各离子浓度的大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+) (6)丙组为等体积等物质的量浓度的一元酸与一元碱混合,混合后溶液中的溶质为NaA,因溶液的pH = 9,即HA为弱酸,A-水解使溶液呈碱性,促进水的电离。水电离出的c(OH-) =10-5 |
相似问题
对于反应A(g)+3B(g)2C(g) 下列各数据表示不同条件下的反应速率 其中反应进行得最快的是A
对于反应A(g)+3B(g)2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是A.v(A)=0 2mol (L?s) B.v(B)= "0 2 " mol (L?s)C.v(B)=0 3mol (L?s) D.v(C)=0 2mol (L?s)
(8分)在2L密闭容器内 800℃时反应:2NO(g)+O2(g)2NO2(g)体系中 n(NO)随
(8分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:时间(s)012345n(NO)(mol)0 0200 0100 0080 0070 0070 007(
甲 乙两容器内都在进行A→B的反应 甲中每分钟减少4 mol 乙中每分钟减少2 mol 则两容器中的
甲、乙两容器内都在进行A→B的反应,甲中每分钟减少4 mol,乙中每分钟减少2 mol,则两容器中的反应速率A.甲快B.乙快C.相等D.无法判断[
在N2+3H22NH3的反应中 在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是
在N2+3H22NH3的反应中,在5s中N2由6mol L减至2mol L。则NH3的平均反应速率是 ( )A.0 08 mol (L·s)B.0 8 mol (L·s)C.1 6mol (L·s)D.2 4 mol (L·s)
反应A+3B=2C+2D在四种不同情况下的反应速率分别为:①v(A)=0.15mol/(L·s)②v
反应A+3B=2C+2D在四种不同情况下的反应速率分别为:①v(A)=0.15mol/(L·s)②v(B)=0.6mol/(L·s)③v(C)=0.4 mol/(L·s)④v(D)=0.45 mol/(L·s)












