食盐是日常生活的必需品 也是重要的化工原料。(1)粗食盐常含有少里K+ Ca2+ Mg2+ Fe3+
| 食盐是日常生活的必需品,也是重要的化工原料。 (1)粗食盐常含有少里K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下: 提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 ___(只填化学式)。 (2)用提纯的NaCl配制500mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。 (3)电解饱和食盐水的装置如图所示,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则 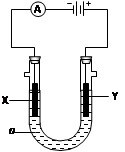 ①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。 ②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。 ③若收集的H2为2 L ,则同样条件下收集的Cl2 (填“>”、“=” 或“<”  2 L,原因是 。 2 L,原因是 。 |
参考解答
| (1)BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。)NaOH溶液的加入顺序及是否答NaOH不影响得分 (2)天平、烧怀、500mL容量瓶、胶头滴管(3)①2H++2e-=H2↑ 放出气体,溶液变红 ②2Cl—2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。 ③ < 电解生成的氯气与电解生成的NaOH发生了反应 |
| (1)考查物质的分离和提纯。除去Ca2+、Mg2+、Fe3+、SO42-离子的试剂分别是乙酸钠、氢氧化钠、氢氧化钠和氯化钡。由于过量的氯化钡需要碳酸钠来除去,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠不受影响。 (2)考查一定物质的量浓度溶液的配制。根据实验原理可知,还缺少的仪器是天平(用来称量)、烧怀(用来溶解)、500mL容量瓶、胶头滴管(用来定容)。 (3)考查电化学的应用。 ①根据装置图可知,X电极和电源的负极相连,作阴极,溶液中的氢离子放电,方程式是2H++2e-=H2↑;由于氢离子放电,破坏来阴极周围水的电离平衡,所以阴极周围溶液显碱性,则溶液呈红色。 ②Y电极和电源的正极相连,作阳极,溶液中的氯离子放电,电极反应式是2Cl—2e-=Cl2↑;氯气具有氧化性,据此可以检验,即把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。 ③由于电解生成的氯气与电解生成的NaOH发生了反应,所以实际收集的氯气小于2L。 |
相似问题
(16分)如图所示 通电5 min后 电极5的质量增加了2.16 g 回答:(1)电源:a是____
(16分)如图所示,通电5 min后,电极5的质量增加了2 16 g,回答:(1)电源:a是________极,C池是________池。A池阳极电极反应式为__________________
高铁酸盐在能源 环境保护等有着广泛的用途 可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定)
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定),总反应式为:Fe+2H2O+20H-3H2↑+FeO42-。下列说
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是A.从E口逸出的气体是H2B.从B口
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是A.从E口逸出的气体是H2B.从B口加入含少量NaOH的水溶液以增强导电性C.标准状况下每
某溶液只含有NaCl和H2SO4两种溶质 它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是A.
工业上生产氯气常用电解槽中电解饱和食盐水 为了避免电解产物之间发生反应 常用阳离子交换膜将电解槽隔成
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。(1)












