(16分)如图所示 通电5 min后 电极5的质量增加了2.16 g 回答:(1)电源:a是____
(16分)如图所示,通电5 min后,电极5的质量增加了2.16 g,回答: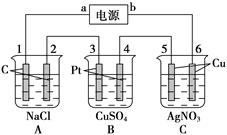 (1)电源:a是________极,C池是________池。 A池阳极电极反应式为__________________,阴极电极反应式为__________________。 C池阳极电极反应式__________________,阴极电极反应式为_____________________。 (2)如果B槽中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______________________。 (3)如果A池溶液也是200 mL(电解过程中溶液体积不变),则通电后,溶液的pH为[________。 |
参考解答
| (1)负 电解 2Cl--2e-===Cl2↑ 2H++2e-===H2↑ Cu-2e-===Cu2+ 2Ag++2e-===2Ag (2)0.025 mol·L-1 (3)13 |
| (1)电极5的质量增加了2.16 g,说明电极5是阴极,则电极6是阳极,所以b是电源的负极,a是电源的负极。则电极1、3是阴极,电极2、4是阳极。A中阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气。C中阳极是铜,属于活性电极,铜失去电子。阴极是溶液中的银离子放电,析出银。 (2)B是电解硫酸铜,阳极是OH-放电产生氧气。阴极先是铜离子放电,析出铜,然后是氢离子放电产生氢气。电极5的质量增加了2.16 g,所以析出的银是0.02mol,转移电子是0.02mol。则B中生成氧气是0.005mol,体积是0.005mol×22.4L/mol=112ml,所以氢气也是112ml。根据电子守恒可知,铜离子得到的电子是0.02mol-0.005mol×2=0.01mol,因此铜离子的物质的量是0.005mol。则硫酸铜的浓度是0.005mol÷0.2L=0.025mol/L。 (3)根据反应式2NaCl+2H2O  2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。 2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。 |
相似问题
高铁酸盐在能源 环境保护等有着广泛的用途 可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定)
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定),总反应式为:Fe+2H2O+20H-3H2↑+FeO42-。下列说
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是A.从E口逸出的气体是H2B.从B口
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是A.从E口逸出的气体是H2B.从B口加入含少量NaOH的水溶液以增强导电性C.标准状况下每
某溶液只含有NaCl和H2SO4两种溶质 它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是A.
工业上生产氯气常用电解槽中电解饱和食盐水 为了避免电解产物之间发生反应 常用阳离子交换膜将电解槽隔成
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。(1)
用离子方程式表示下列化学变化:(1)电解氯化钠溶液_________________________
用离子方程式表示下列化学变化:(1)电解氯化钠溶液____________________________________________(2)电解硝酸银溶液____________________________________________












