工业上生产氯气常用电解槽中电解饱和食盐水 为了避免电解产物之间发生反应 常用阳离子交换膜将电解槽隔成
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。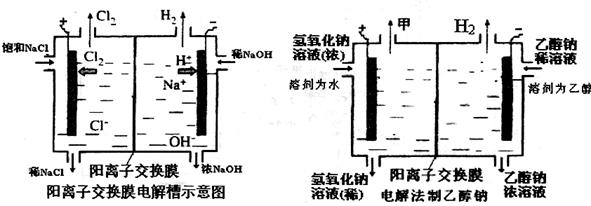 (1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号) ①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH- (2)写出在电解过程中发生的电极方程式阳极: 。 (3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。 (4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题: ①写出在电解过程中发生的电极方程式 阴极: 。 ②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。 |
参考解答
| (1)③⑤(3分)(2)阳极;2Cl--2e-=Cl2(3分) (3)35.7%(3分) (4)①阴极:2CH3CH2OH+2e-=2CH3CH2O-+H2(3分)②蒸发结晶 (3分) |
试题分析:(1)阳离子交换膜只允许阳离子钠离子、氢离子通过,而阴离子和分子均不能通过,故答案为:③⑤。 (2)电解池中和电源的正极相连的是电解池的阳极,阳极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑。 (3)氢气的物质的量=896L÷22.4L/mol=40mol,质量为40mol×2g/mol=80g,根据电解方程式:2NaCl+2H2O  2NaOH+H2↑+Cl2↑,可得生成的NaOH为:m(NaOH)=2×40mol×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量,为:2×40mol×23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,电解后流出的氢氧化钠溶液的质量分数=4200g÷11760g×100%=35.7%。 2NaOH+H2↑+Cl2↑,可得生成的NaOH为:m(NaOH)=2×40mol×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量,为:2×40mol×23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,电解后流出的氢氧化钠溶液的质量分数=4200g÷11760g×100%=35.7%。(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+2e-=2CH3CH2O-+H2↑。 ②从溶液中析出溶质的方法是蒸发结晶,故答案为:蒸发结晶. |
相似问题
用离子方程式表示下列化学变化:(1)电解氯化钠溶液_________________________
用离子方程式表示下列化学变化:(1)电解氯化钠溶液____________________________________________(2)电解硝酸银溶液____________________________________________
在水中加入等物质的量的Ag+ Pb2+ Na+ SO42— NO3— Cl— 该溶液放在用惰性材料做
在水中加入等物质的量的Ag+、Pb2+、Na+、SO42—、NO3—、Cl—,该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为A
用惰性电极电解+n价金属的硝酸盐溶液 当阴极上析出mg金属时 阳极上产生560mL(标准状况)气体
用惰性电极电解+n价金属的硝酸盐溶液,当阴极上析出mg金属时,阳极上产生560mL(标准状况)气体,此金属的相对原子质量应为A.10m nB.10mC.10nD.40mn
在25 ℃时 用石墨电极电解1000mL一定浓度的CuCl2溶液。5 min后电解完全 在一个石墨电
在25 ℃时,用石墨电极电解1000mL一定浓度的CuCl2溶液。5 min后电解完全,在一个石墨电极上只有1 28 g Cu生成。试回答下列问题:(1)总反应式为。
电解稀H2SO4 Cu(NO3)2 NaCl的混合液 最初一段时间阴极和阳极上分别析出的物质分别是(
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质分别是()A.H2和Cl2B.Cu和Cl2C.H2和O2D.Cu和O2












