25℃时 将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
|
参考解答
| C |
试题分析:A、由于氨水和盐酸的浓度未知,混合溶液可能氨水有剩余,可能显示碱性或中性,可能恰好完全反应或盐酸有剩余,溶液显酸性,正确;B、根据电荷守恒判断,混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-),正确;C、根据氯化铵溶液中的物料守恒判断,若a=b,则反应后的溶液为氯化铵溶液,c(C1-)=c(NH4+)+c(NH3·H2O),错误;D、若混合溶液显中性;则NH3·H2O的电离平衡常数为 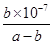 mol·L-1,正确。 mol·L-1,正确。 |
相似问题
运用电离常数判断可以发生的反应是酸电离常数(25oC)碳酸Ki1=4.3×10-7 Ki2=5
运用电离常数判断可以发生的反应是酸电离常数(25oC)碳酸Ki1=4 3×10-7 Ki2=5 6×10-11次溴酸Ki=2 4×10-9A.HBrO+Na2CO3→NaBrO+NaHCO3B.2HBrO+
氢氰酸(HCN)的下列性质中 可以证明它是弱电解质的是( )A.0.1mol/L该酸溶液的pH约
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是()A.0 1mol L该酸溶液的pH约为3B.HCN水溶液中, c(H+)> c(OH-)C.10 mL1mol LHCN恰好与10
高氯酸 硫酸 硝酸和盐酸都是强酸 其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:酸HClO4H2SO4HClHNO3Ka1 6×10-56 3×10-91
能说明醋酸是弱电解质的事实是 A.醋酸水溶液能使湿润的蓝色石蕊试纸变红B.醋酸和碳酸钠溶液反应放出二
能说明醋酸是弱电解质的事实是 A.醋酸水溶液能使湿润的蓝色石蕊试纸变红B.醋酸和碳酸钠溶液反应放出二氧化碳C.c(H+)相同的醋酸和盐酸相比较,醋酸溶
在25℃时 用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L 随溶液的稀释 下列各项中始终
在25℃时,用蒸馏水稀释1 mol L的醋酸溶液至0 01 mol L,随溶液的稀释,下列各项中始终保持增大趋势的是 ( )A.B.C.D.












