某化学反应 3 A 2 B + D在四种不同条件下进行 B D的起始浓度为0。反应物A 的浓度
某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表: 2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表: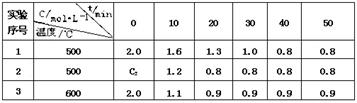 根据上述数据,完成下列填空: (1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min) (2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________ (3)比较实验3和实验 1,可推测正反应是______反应(填吸热或放热)。理由是____ |
参考解答
| 1)0.03 mol /(L·min) (2)2.0mol / L ,催化剂 (3)放热反应,理由是升高温度平衡向逆向移动,所以正反应是放热反应 |
试题分析:(1)中,在实验 1 ,反应在10 min ~20 min 内平均速率为 (1.6-1.3)/10 mol /(L·min)='0.03' mol /(L·min);(2)中,在实验 2 ,A 的初始浓度为2.0mol / L ,因为刚开始生成物都为0,催化剂能够缩短达到平衡的时间,所以实验 2 中还隐含的条件是催化剂;(3)中,温度升高,A的含量增大,说明了平衡向左移动,由此可以知道正反应是放热反应,理由是升高温度平衡向逆向移动,所以正反应是放热反应。 点评:本题考查了化学反应速率,平衡的移动,是高考的常考题型,本题比较基础,学生很容易得高分。 |
相似问题
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中 该铝片与
把在空气中久置的铝片5 0 g投入盛有500 mL 0 5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回
一定温度下有可逆反应:A(g)+2B(g) 2C(g)+D(g) 。现将5molA和10molB加入
一定温度下有可逆反应:A(g)+2B(g) 2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间
在25℃时 向100mL含氯化氢14.6g的盐酸里 放入5.6g铁粉(不考虑反应前后溶液体积的变化)
在25℃时,向100mL含氯化氢14 6g的盐酸里,放入5 6g铁粉(不考虑反应前后溶液体积的变化),反应开始到2min末收集到H2 1 12L(标准状况),在此后,又经
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤 已知SO2(g)+O2(g) SO3
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知SO2(g)+O2(g)SO3(g)△H=-98 kJ·mol-1。(1)某温度下该反应的平衡常数K=
对反应:A+BAB来说 常温下按以下情况进行反应:①20 mL溶液中含A B各0.01 mol②50
对反应:A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0 01 mol②50 mL溶液中含A、B各0 05 mol③0 1 mol·L-1的A、B溶液各10 mL












