利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤 已知SO2(g)+O2(g) SO3
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知 SO2(g)+ 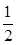 O2(g) O2(g) SO3(g)△H=-98 kJ·mol-1。 SO3(g)△H=-98 kJ·mol-1。(1)某温度下该反应的平衡常数K= 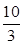 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 molSO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正 v逆(填“<”、“>”或“=”)。 (2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。 (3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。 A保持温度和容器体积不变,充入1.0 mol O2 B保持温度和容器内压强不变,充入1.0 mol SO3 C降低温度 D移动活塞压缩气体 (4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 。 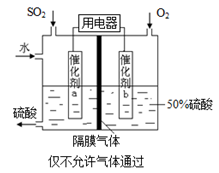 (5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 。 |
参考解答
| (1)> (2)60% (3)A、C (4)O2+4e-+4H+=2H2O (5)16:29 |
(1)向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),可得K`=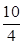 ,K`<K,故反应向正反应方向移动,正反应速率>逆反应速率。 ,K`<K,故反应向正反应方向移动,正反应速率>逆反应速率。(2)根据SO2(g)+ 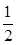 O2(g) O2(g) SO3(g),体积为2 L的密闭容器中充入2.0 mol SO2和1.0 SO3(g),体积为2 L的密闭容器中充入2.0 mol SO2和1.0molO2,达到平衡后体积变为1.6 L,可知反应后压强变为原来的1.6L/2L=80%,故反应后的总物质的量为(2+1)×80%=2.4mol。 SO2(g)+1/2O2(g)  SO3(g) SO3(g)起始物质的量 2mol 1mol 0mol 变化物质的量 2a a 2a 平衡物质的量 2-2a 1-a 2a 故(2-2a)+(1-a)+2a='2.4mol' 则a=0.6mol,所以SO2的转化率为(2×0.6)mol/2mol×100%=60% (3)A中加入反应物氧气,反应向正反应方向进行,SO2浓度降低。B中加入SO2,反应向正反应方向进行,但SO2转化率降低,浓度升高。C中该反应为放热反应,降低温度,向正反应方向进行,SO2浓度降低。D中活塞压缩体积,平衡向正反应方向移动,但体积减小,浓度增大,故选择A、C选项。 (4)O2+4e-+4H+=2H2O (5)该反应的总反应方程式应为2SO2+O2+2H2O=2H2SO4,设加入SO2的物质的量为a,加入H2O的物质的量为b,所以有98a/[98a+18(b-a) =0.5,则a:b=9:58。则二者的质量之比为16:29。 |
相似问题
对反应:A+BAB来说 常温下按以下情况进行反应:①20 mL溶液中含A B各0.01 mol②50
对反应:A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0 01 mol②50 mL溶液中含A、B各0 05 mol③0 1 mol·L-1的A、B溶液各10 mL
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0 45 mol·L-1·min-1②v(B)=0 6 mol·L-1·s-1③v(C)=0 4 mol·L-1·
在可逆反应2A(g)+3B(g)xC(g)+D(g)中 已知:反应开始加入的物质只有A B 起始浓度
在可逆反应2A(g)+3B(g)xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0 5 mol·L-
某合作小组同学将铜片加入稀硝酸 发现开始时反应非常慢 一段时间后反应速率明显加快。该小组通过实验探究
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。(1)该反应的离子方程式为__________
将N2 H2的混合气体分别充入甲 乙 丙三个容器中 进行合成氨反应 经过相同的一段时间后 测得反应速
将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙












