在25℃时 向100mL含氯化氢14.6g的盐酸里 放入5.6g铁粉(不考虑反应前后溶液体积的变化)
| 在25℃时,向100mL含氯化氢14.6g的盐酸里,放入5.6g铁粉(不考虑反应前后溶液体积的 变化),反应开始到2min末收集到H2 1.12L(标准状况),在此后,又经过4min,铁粉完全溶解。则: (1)在前2min内用FeCl2 表示的平均反应速率是多少? (2)在后4min内用HCl表示的 平均反应速率是多少? (3)前2min与后4min相比,反应速率哪个较快?为什么? |
参考解答
| (1) 0.25mol·(L·min)—1 、 (2)0.25 mol·(L·min)—1 (3)2min 反应速率快。因为反应物浓度减小,反应速率减慢。 |
试题分析:(1)反应开始到2min末收集到H2 1.12L(标准状况) 则氢气的物质的量是1.12L÷22.4L/mol=0.05mol 因此生成0.05mol氯化亚铁 所以在前2min内用FeCl2 表示的平均反应速率是 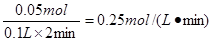 (2)铁的物质的量是5.6g÷56g/mol=0.1mol 在前2min内消耗铁是0.05mol 所以后4min内消耗铁是0.1mol-0.05mol=0.05mol 所以消耗氯化氢的物质的量是0.05mol×2=0.1mol 则在后4min内用HCl表示的平均反应速率是 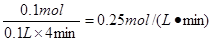 (3)因为反应物浓度减小,反应速率减慢,所以前2min与后4min相比,2min 反应速率快。 点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。主要是考查学生对反应速率概念以及有关计算的熟悉掌握程度,有利于培养学生的规范答题能力,提高学生的应试能力和学习效率。 |
相似问题
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤 已知SO2(g)+O2(g) SO3
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知SO2(g)+O2(g)SO3(g)△H=-98 kJ·mol-1。(1)某温度下该反应的平衡常数K=
对反应:A+BAB来说 常温下按以下情况进行反应:①20 mL溶液中含A B各0.01 mol②50
对反应:A+BAB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0 01 mol②50 mL溶液中含A、B各0 05 mol③0 1 mol·L-1的A、B溶液各10 mL
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0 45 mol·L-1·min-1②v(B)=0 6 mol·L-1·s-1③v(C)=0 4 mol·L-1·
在可逆反应2A(g)+3B(g)xC(g)+D(g)中 已知:反应开始加入的物质只有A B 起始浓度
在可逆反应2A(g)+3B(g)xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0 5 mol·L-
某合作小组同学将铜片加入稀硝酸 发现开始时反应非常慢 一段时间后反应速率明显加快。该小组通过实验探究
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。(1)该反应的离子方程式为__________












