由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:(1)操作Ⅱ的名称是_______
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下: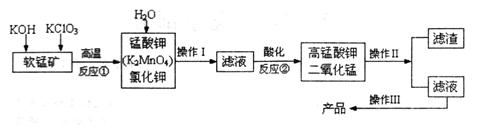 (1)操作Ⅱ的名称是____________。 (2)可循环利用的物质____________(填化学式)。 (3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。 (4)反应②中“酸化”时不能选择下列酸中的______(填字母序号) A.稀盐酸 B.稀硫酸 C.稀醋酸 (5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)  |
参考解答
| (16分) (1)过滤 (2分) (2)MnO2 (2分) (3)2:1 (2分) (4)A (2分) (5)负 (2分),MnO42-—e-=MnO4- (3分);31.6 (3分) |
试题分析:工艺流程题解题的关键是要搞清楚加入什么物质,发生什么反应,如何分离等,通过分析,我们要能够将一个工艺的流程转化为物质的流程。第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42-+4H+=2MnO4-+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品。整个过程中MnO2可以循环利用。 (4)因锰酸根和高锰酸根均具有强氧化性,不能使用盐酸(具有还原性); (5)铁为活性电解,这里没有参与反应,做阴极故与负极相连。阳极发生氧化反应,锰酸根失电子生成高锰酸根,根据电子得失守恒可以进行相关计算。 |
相似问题
铅蓄电池放电时发生下列变化:负极:Pb+SO42—-2e-===PbSO4 正极:PbO2+4H++
铅蓄电池放电时发生下列变化:负极:Pb+SO42—-2e-===PbSO4正极:PbO2+4H++SO42—+2e-===PbSO4+2H2O,使用该电池电解CuSO4溶液,要得到纯铜1.6
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解
将质量分数为0 052(5 2%)的NaOH溶液1 L(密度为1 06 g·cm-3)用铂电极电解,当溶液中的NaOH的质量分数改变了0 010(1 0%)时停止电解,则此时溶液中应符
已知在pH为4~5的溶液中 Cu2+几乎不水解 而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3 8酸化的、含有Fe2(S
下列关于电解池的叙述中不正确的是( )A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解
下列关于电解池的叙述中不正确的是( )A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.电解池的阳极发生氧化反应D.电解池的
甲 乙两个电解池均为 Pt 电极 且互相串联 甲池盛有AgNO3溶液 乙池中盛有一定量的某盐溶液 通
甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2 16g,乙池












