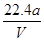已知在pH为4~5的溶液中 Cu2+几乎不水解 而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是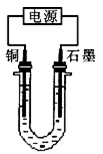
|
参考解答
| C |
| 本题是利用CuO粉末除去混合液中的H2SO4,促使Fe3+水解生成Fe(OH)3沉淀而除去。计算Cu的相对原子质量应根据电解过程中阴、阳极转移电子数相等计算。黑色粉末X是CuO粉末,A错;铜电极连接电源负极,B错;铜的相对原子质量的计算式是11200a/V,D错;石墨电极上发生的反应是4OH--4e-=O2↑+2H2O,C正确。故本题选C。 |
相似问题
下列关于电解池的叙述中不正确的是( )A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解
下列关于电解池的叙述中不正确的是( )A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.电解池的阳极发生氧化反应D.电解池的
甲 乙两个电解池均为 Pt 电极 且互相串联 甲池盛有AgNO3溶液 乙池中盛有一定量的某盐溶液 通
甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2 16g,乙池
高铁酸钾(K2FeO4)是铁的一种重要化合物 具有极强的氧化性。(1)将适量K2FeO4溶解于pH=
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性。(1)将适量K2FeO4溶解于pH=4 74的溶液中,配制成c(FeO42-)=1 0×10-3mol·L-的试样,将
如右图所示 U形管内盛有100mL的溶液 按要求回答下列问题:(1)打开K2 合并K1 若所盛溶
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为。若所盛溶液
下列关于电解质溶液的叙述正确的是A.中和pH与体积都相同的盐酸和硫酸 消耗NaOH的物质的量之比是1
下列关于电解质溶液的叙述正确的是A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均