已知在25°C 1.013×105Pa下 1mol氢气完全燃烧生成液态水放出285kJ的热量 请回答
| 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: (1)若2mol氢气完全燃烧生成水蒸气,则放出的热量______ (填“>”、“<”或“=”)570kJ (2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极均由多孔的碳块组成.该电池的正极为:______(填A或B).若该电池工作时增加了1mol H2O,电 路中转移电子的物质的量为______ mol. (3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:______. 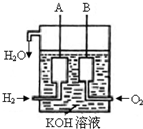 |
参考解答
| (1)1mol氢气完全燃烧生成液态水放出285kJ的热量,所以2mol氢气完全燃烧生成液态水放出570kJ的热量,但是液态水变为气态水时,要吸收一部分热量,所以2mol氢气完全燃烧生成水蒸气,则放出的热量<570kJ,故答案为:<; (2)燃料电池中,正极上通的一定是氧气,所以B极是正极,根据电池反应:2H2+O2
(3)燃料电池的负极一定是燃料失电子的过程,在碱性环境下,甲烷失电子的电极反应为:CH4+8e-+10OH-=CO32-+7H2O,故答案为:CH4+8e-+10OH-=CO32-+7H2O. |
相似问题
(14分)铅蓄电池是可充电型电池 它的正负极极板是惰性材料 电池总反应式为:Pb+PbO2+4H+
(14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2PbSO4+2H2O请回答下列问题(不考虑氢、氧的氧化还原)
理论上讲 任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3
理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3)2+2Ag设计一个原电池装置.(1)画出装置图,并标明电极材料
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为:_______________
如图为蕃茄电池(注:番茄汁中含有苹果酸 柠檬酸等有机酸) 下列说法正确的是( )A.一段时间后
如图为蕃茄电池(注:番茄汁中含有苹果酸、柠檬酸等有机酸),下列说法正确的是()A.一段时间后,锌片质量会变小B.铜电极附近会出现蓝色C.电子由铜通
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料 其储氢原理可表示为Li
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是A.Li2NH中N












