(14分)铅蓄电池是可充电型电池 它的正负极极板是惰性材料 电池总反应式为:Pb+PbO2+4H+
| (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为: Pb+PbO2+4H++2SO 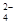  2PbSO4+2H2O 2PbSO4+2H2O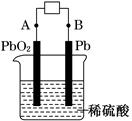 请回答下列问题(不考虑氢、氧的氧化还原): (1) 该蓄电池放电工作时的负极材料是 ,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加 g。 充电时,上图中A极应接直流电源的 (填“正极”或“负极”)。充电时A极的电极反应式是 ; (2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。 |
参考解答
| (1)铅 48, 正 PbSO4+2H2O-2e-= PbO2+4H++SO42- (2)2H++2e-=H2 0.2mol 8.7 |
试题分析:(1)根据电池的总反应可知,铅蓄电池放电时的负极发生氧化反应,所以负极材料为Pb,发生的电极反应为Pb-2e-+SO42-=PbSO4,因此负极增加的质量为SO42-的质量,用该电池电解氯化钠溶液时,当阳极上收集11.2L氯气时,转移1mol电子,所以负极增加48g。充电时,A极应发生氧化反应,所以与电源正极相连,电极反应为PbSO4+2H2O-2e-= PbO2+4H++SO42-。 (2)电解酸化的MnSO4溶液,阴极发生还原反应,电极反应为2H++2e-=H2。根据铅蓄电池的总反应可知,1molH2SO4参加反应转移1mol电子,所以0.4mol H+被消耗时,转移0.2mol 电子,生成MnO20.1mol,质量为8.7g。 点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。 |
相似问题
理论上讲 任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3
理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3)2+2Ag设计一个原电池装置.(1)画出装置图,并标明电极材料
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为:_______________
如图为蕃茄电池(注:番茄汁中含有苹果酸 柠檬酸等有机酸) 下列说法正确的是( )A.一段时间后
如图为蕃茄电池(注:番茄汁中含有苹果酸、柠檬酸等有机酸),下列说法正确的是()A.一段时间后,锌片质量会变小B.铜电极附近会出现蓝色C.电子由铜通
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料 其储氢原理可表示为Li
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是A.Li2NH中N
如图为氢氧燃料电池原理示意图 请根据提示写出正负极的电极反应式(1)以硫酸为电解液:负极:_____
如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式(1)以硫酸为电解液:负极:______正极:______(2)以氢氧化钾为电解液:负极:_____












