理论上讲 任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3
| 理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3)2+2Ag设计一个原电池装置. (1)画出装置图,并标明电极材料和电解质溶液; (2)写出电极反应式: 正极:______; 负极:______. (3)若导线上转移电子0.1mol,则生成银______克. |
参考解答
(1)根据反应方程式知,选铜、银作电极材料,硝酸银溶液作电解质溶液,该装置图为: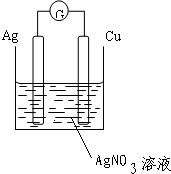 (2)根据电极材料的活泼性判断正负极,较活泼的铜作负极,失去电子变成离子进入溶液,银作正极,银离子得电子生成银单质,故答案为:(+)2Ag++2e-=2Ag,(-)Cu-2e-=Cu2+ (3)Cu+2AgNO3 =Cu(NO3)2 +2Ag 转移电子 (2×108)g 2mol 10.8g 0.1mol 故答案为 10.8 |
相似问题
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少
沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:则:(1)在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为:_______________
如图为蕃茄电池(注:番茄汁中含有苹果酸 柠檬酸等有机酸) 下列说法正确的是( )A.一段时间后
如图为蕃茄电池(注:番茄汁中含有苹果酸、柠檬酸等有机酸),下列说法正确的是()A.一段时间后,锌片质量会变小B.铜电极附近会出现蓝色C.电子由铜通
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料 其储氢原理可表示为Li
NH3中氢原子可被锂原子替代。亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2→LiNH2+LiH。下列有关说法正确的是A.Li2NH中N
如图为氢氧燃料电池原理示意图 请根据提示写出正负极的电极反应式(1)以硫酸为电解液:负极:_____
如图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式(1)以硫酸为电解液:负极:______正极:______(2)以氢氧化钾为电解液:负极:_____
碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O =' 2MnOOH' + Zn(OH)2
碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O =" 2MnOOH" + Zn(OH)2,电解质是KOH。下列说法正确的是 A.碱性锌锰电池是二次电池B.MnO2发生了还












