氮是地球上含量丰富的一种元素 氮及其化合物在工农业生产 生活中有着重要作用.请回答下列问题:(1)如
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: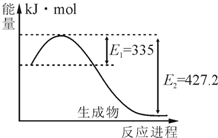 (1)如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为______. (2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递HH+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 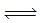 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
①试确定K1的相对大小,K1______4.1×106(填写“>”“=”或“<”) ②下列各项能作为判断该反应达到化学平衡状态的依据的是______(填序号字母). A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)=v(H2)(逆) C.容器内压强保持不变 D.混合气体的密度保持不变 (4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是______. ②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为______ A.C(Cl-)>C(NH4+)>C(H+)>C(OH-) B.C(NH4+)>C(Cl-)>C(OH-)>C(H+) C.C(Cl-)>C(NH4+)>C(OH-)>C(H+) D.C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
参考解答
| (1)该反应的焓变△H=E1-E2=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以每生成1molNH3放出热量为46.1kJ.故答案为:46.1kJ; (2)阴极上N2得到电子,形成阴离子,阴离子再与质子结合,阴极反应式为N2+6H++6e-=2NH3; 故答案为:N2+6H++6e-=2NH3; (3)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K减小, 故答案为:<; ②A、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误; B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,故B错误. C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确; D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误. 故选:C. (4)①盐NH4Cl在水溶液中电离出的NH4+结合重水(D2O)电离出的OD-,生成NH3?HDO,而由重水(D2O)电离出的D+与重水(D2O)结合生成D3O+,故答案为:NH3?HDO和D3O+; ②NH3?H2O是弱电解质,HCl是强电解质,x+y=14,混合液氨水过量,PH>7,溶液中的溶质为NH3?H2O,NH4Cl, 所以c(NH4+)>c(Cl-)>c(OH-)>c(H+),故选:B. |
相似问题
现有反应:CO(g)+H2O(g)CO2(g)+H2(g) 其△H<0 在850℃时 Kc=1。(1
现有反应:CO(g)+H2O(g)CO2(g)+H2(g),其△H<0,在850℃时,Kc=1。(1)若升高温度到950℃时,达到平衡时Kc______1(填“大于”、“小于”或“
在密闭容器中 对于反应N2+3H22NH3 在反应起始时N2和H2分别为10mol和30mol 当达
在密闭容器中,对于反应N2+3H22NH3,在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%。若以NH3为起始反应物,反应条件与上述反应
在其他条件不变时 改变某一条件对A:(g)+3B(g)═2AB3 (g) 化学平衡状态的影响 得到如
在其他条件不变时,改变某一条件对A:(g)+3B(g)═2AB3,(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度).下列结论正确的是(
对于3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 反应的化学平衡常数的表达式为[
对于3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为[ ]A.B.C.D.
钨是属于有色金属 也是重要的战略金属 钨矿在古代被称为“重石”.1783年被西班牙人德普尔亚发现黑钨
钨是属于有色金属,也是重要的战略金属,钨矿在古代被称为“重石”.1783年被西班牙人德普尔亚发现黑钨矿也从中提取出钨酸,同年,用碳还原三氧化钨第一












