已知室温时 0.1mol/L某一元酸HA在水中有0.1%发生电离 下列叙述错误的是 ( )A.升高
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
|
参考解答
| A |
试题分析:0.1 mol/L某一元酸HA在水中有0.1%发生电离,则溶液中c(H+)=c(A-)=0.1 mol/L×0.1%=10-4mol/L,因此pH=4,C正确;升高温度促进电离,酸性增强,pH减小,A不正确;该酸的电离平衡常数= 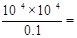 10-7,B正确;弱酸的电离都是吸热的,升高温度,平衡正向移动,电离平衡常数增大,D正确,答案选A。 10-7,B正确;弱酸的电离都是吸热的,升高温度,平衡正向移动,电离平衡常数增大,D正确,答案选A。点评:本题主要根据电离程度计算出电离平衡常数。 |
相似问题
25℃时 下列叙述中 正确的是( )A.CH3COONa溶液中:c(Na+) = c(CH3COO
25℃时,下列叙述中,正确的是()A.CH3COONa溶液中:c(Na+) = c(CH3COO-)B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小C.pH相同的NaOH
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。化学式电离平衡常数(25℃)NH3·H2O
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。化学式电离平衡常数(25℃)NH3·H2OKb=1 77×10-5HCNKa=4 93×10-10CH3COOHKa=1 76×10-5H
今有A.醋酸 B.盐酸 C.硫酸三种酸 请用三种酸的序号和“>” “<”或“=”填空。(1)在同体
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,
有0.1 mol/L的盐酸溶液(a) 硫酸溶液(b) 醋酸溶液(c)各50 mL 试比较:(1)三种
有0 1 mol L的盐酸溶液(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:(1)三种酸的氢离子浓度由大到小的顺序是________(填字母代号,下同);三种酸的p
下列各溶液中 微粒的物质的量浓度关系表述正确的是( )A.将pH=5的硫酸溶液稀释1000倍后
下列各溶液中,微粒的物质的量浓度关系表述正确的是()A.将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1 :20B.0 1 mol L NaHC












