Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中 测量温度
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答: (1)NaOH溶液稍过量的原因 。 (2)加入NaOH溶液的正确操作是 (填字母)。 A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入 (3)使硫酸与NaOH溶液混合均匀的正确操作是 。 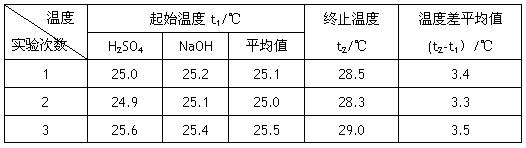 (4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c="4.18" J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________ (5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是 Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作: A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂 C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解 D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL 试填空: (1)正确操作步骤的顺序是 (用字母表示)。 (2)观察滴定管液面的高度时应注意 (3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。 (4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是 (5)该烧碱样品纯度的计算式为_________________________。 |
参考解答
| Ⅰ、(1)确保硫酸被完全中和 (2)B (3)用环形玻璃棒轻轻搅动 (4)56.85 kJ·mol-1 , H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O ΔH=-113.7kJ·mol-1 (5)大于 浓硫酸溶于水放出热量 Ⅱ.答案:(1)CABDE (2)滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL (3)使滴定终点颜色变化更明显,便于分辨 (4)偏高 因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高 (5)0.8(V2-V1)M/W×100% |
| 略 |
相似问题
(8分)CO CH4均为常见的可燃性气体。(1)等体积的CO和CH4在相同条件下分别完全燃烧 转移的
(8分)CO、CH4均为常见的可燃性气体。(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是(2)已知在101kPa时,CO的燃烧热为283kJ mol
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ?mol-1(Q>0)某温度、压强下,将一定量反应物通入密闭容器进
下列说法正确的是A.放热反应在任意条件下都能自发进行B.已知热化学方程式2A(g)+B(g)2C(g
下列说法正确的是A.放热反应在任意条件下都能自发进行B.已知热化学方程式2A(g)+B(g)2C(g)△H=-a kJ·mol-1(a>0)将2molA(g)和1molB(g)置于一密闭
下列说法或表示方法中正确的是( )A.吸热反应中 新化学键形成吸收能量;放热反应中 新化学键形成放
下列说法或表示方法中正确的是( )A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量B.等质量的硫蒸气和硫磺分别完全燃烧,
(4分)(1)下列反应中 属于放热反应的是 属于吸热反应的是
(4分)(1)下列反应中,属于放热反应的是,属于吸热反应的是。①燃烧反应②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳⑤食物因氧化而腐败⑥Ba(OH)2












