氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g)2NH3(g) Δ
| 氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是: N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题: 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题: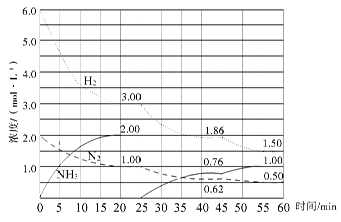 (1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数) (2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。 (3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。 (4)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是____________ (5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。
 |
参考解答
(1)0.15(2分) (2) v1>v2>v3 (2分) (3) α3 (2分) (4)正反应方向移动(1分) 移走生成物NH3(1分) (5) 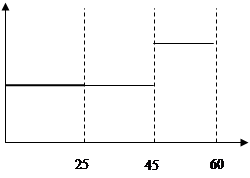 (2分) (2分) |
试题分析:⑴ 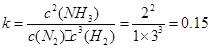 ;⑵化学反应速率是用单位时间内反应物或生成物浓度的变化量来表示的,5~10 min、25~30min和45~50 min,这三段时间间隔是相同的,只要比较他们的浓度变化就可以,从图上可以看出,这三段时间变化的大小分别为:v1>v2>v3;⑶转化率就是反应掉的物质的量或者浓度与原来的物质的量或者浓度的比,从图中数据变化可知变化最小的是α3;⑷从图中可以看出,由第一次平衡到第二次平衡,反应物的浓度减小,肯定是正向移动,但是氨的浓度从零开始,表明采取的措施是移走生成物NH3。⑸25~45min,温度没有变化,而平衡常数是只随温度的改变而改变的。因此在这一范围内,K值不变;45~60min,平衡继续正向移动,在45分钟这个时间,各物质的浓度没有发生变化,因些平衡移动与浓度和压强变化无关,只能是降低了温度而引起的平衡移动。因为温度发生了变化,因此平衡常数也发生还应的改变,使得K值增大。 ;⑵化学反应速率是用单位时间内反应物或生成物浓度的变化量来表示的,5~10 min、25~30min和45~50 min,这三段时间间隔是相同的,只要比较他们的浓度变化就可以,从图上可以看出,这三段时间变化的大小分别为:v1>v2>v3;⑶转化率就是反应掉的物质的量或者浓度与原来的物质的量或者浓度的比,从图中数据变化可知变化最小的是α3;⑷从图中可以看出,由第一次平衡到第二次平衡,反应物的浓度减小,肯定是正向移动,但是氨的浓度从零开始,表明采取的措施是移走生成物NH3。⑸25~45min,温度没有变化,而平衡常数是只随温度的改变而改变的。因此在这一范围内,K值不变;45~60min,平衡继续正向移动,在45分钟这个时间,各物质的浓度没有发生变化,因些平衡移动与浓度和压强变化无关,只能是降低了温度而引起的平衡移动。因为温度发生了变化,因此平衡常数也发生还应的改变,使得K值增大。 |
相似问题
如图是可逆反应X2+3Y22Z2在反应过程中的反应速率V与时间(t)的关系曲线 下列叙述正确的是A.
如图是可逆反应X2+3Y22Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是A.t1时,只有正方向反应B.t2时,反应到达限度C.t2-t3,反
在密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH
在密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是() A.
下列事实不能用勒夏特列原理解释的是[ ]A.温度控制在500℃有利于合成氨反应 B.实验室中
下列事实不能用勒夏特列原理解释的是[ ]A.温度控制在500℃有利于合成氨反应 B.实验室中常用排饱和食盐水的方法收集Cl2 C.将相同体积、相同pH盐酸与
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素 离子方程式为:2MnO4-+5H2
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时
将2mol A和2molB充入某密闭容器中发生如下反应:2A(g)+B(g)xC(g) 达到化学平衡
将2molA和2molB充入某密闭容器中发生如下反应:2A(g)+B(g)xC(g),达到化学平衡后,C的体积分数为a,假设该反应的条件分别和下列各选项的条件相同,












