用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素 离子方程式为:2MnO4-+5H2
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):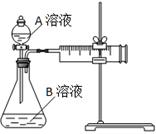
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL) (3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。 (4)小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、② 。 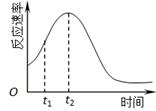 |
参考解答
| (10分) (1)浓度(2分) ②>①(2分) (2)0.0092(2分) (3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间(2分) (4)该反应放热(2分) |
试题分析:(1)根据表中所列是数据分析,实验探究的是浓度因素对化学反应速率的影响。浓度越大反应速率越快,生成的CO2的体积越大,即②>①。 (2)4.48 mL CO2,即0.0002mol,根据化学方程式计算,反应的MnO4-是0.00004mol,剩余的MnO4-是0.0005mol-0.00004mol=0.00046mol,故c(MnO4-)=0.0092mol·L-1。 (3)KMnO4是有颜色的,故还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率。 (4)升高温度会加快反应的速率。 点评:本题考查了影响化学反应速率的因素及计算,难度中等,注意决定反应速率的是物质本身的性质,外界条件只是影响因素。 |
相似问题
将2mol A和2molB充入某密闭容器中发生如下反应:2A(g)+B(g)xC(g) 达到化学平衡
将2molA和2molB充入某密闭容器中发生如下反应:2A(g)+B(g)xC(g),达到化学平衡后,C的体积分数为a,假设该反应的条件分别和下列各选项的条件相同,
氮有多种氧化物 其中N2O5是一种新型硝化剂 其性质和制备收到人们的关注。(1)一定温度下 在恒容密
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O
温度为T时 向2.0L恒容密闭容器中充入1.0molPCl5 反应 经一段时间后达到平衡。反应过程中
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应经一段时间后达到平衡。反应过程中测定的部分数据见下表:t s050150250350n(PCl3) mol00.160
固定和利用CO2能有效地利用资源 并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H = -49 0 k
已知:4NH3 (g)+5O2(g)4NO(g)+6H2O(g)ΔH=-1025 kJ/mol 若反
已知:4NH3 (g)+5O2(g)4NO(g)+6H2O(g)ΔH=-1025 kJ mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是












