温度为T时 向2.0L恒容密闭容器中充入1.0molPCl5 反应 经一段时间后达到平衡。反应过程中
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应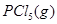  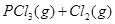 经一段时间后达到平衡。反应过程中测定的部分数据见下表: 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是( ) A.反应在前50s的平均速率为 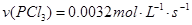 B.保持其他条件不变,升高温度,平衡时, 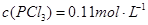 ,则反应的 ,则反应的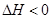 C.相同温度下,起始时向容器中充入 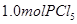 、 、 和 和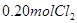 ,达到平衡前v(正)>v(逆) ,达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入 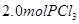 、 、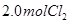 ,达到平衡时, ,达到平衡时,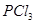 的转化率小于80% 的转化率小于80% |
参考解答
| C |
试题分析: A、由表中数据可知50s内,△n(PCl3)=0.16mol,根据v=△n/v△t计算v(PCl3)=0.0016mol/(L?s),错误; B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)='0.11' mol/L,则n′(PCl3)='0.11' mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,错误;C、利用三行式求的该反应的平衡常数k=0.025,起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Q=0.02,Q<K,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于80%,错误。 |
相似问题
固定和利用CO2能有效地利用资源 并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H = -49 0 k
已知:4NH3 (g)+5O2(g)4NO(g)+6H2O(g)ΔH=-1025 kJ/mol 若反
已知:4NH3 (g)+5O2(g)4NO(g)+6H2O(g)ΔH=-1025 kJ mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g)
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4(g)和1m
运用化学反应原理研究氮 硫等单质及其化合物的反应有重要意义(1)硫酸生产过程中2SO2(g)+O2(
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义(1)硫酸生产过程中2SO2(g)+O2(g)2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右
在密闭容器中将CO和水蒸气的混合物加热到800℃时 有下列平衡:CO+H2OCO2+H2 且K=1。
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2OCO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为 (












