工业上利用锌焙砂(主要含ZnO ZnFe2O4 还含有少量CaO FeO CuO NiO等氧化物)制
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: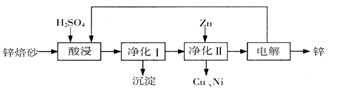 (1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为 (2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。 ①写出酸性条件下H2O2与Fe2+反应的离子方程式 ②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃, 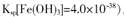 。 。③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。 (3)若没有净化II操作,则对锌的制备带来的影响是 。 (4)本流程中可以循环利用的物质除锌外还有 。 |
参考解答
| (1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①H2O2+2Fe2++2H+═2Fe3++2H2O;②4.0×10-5mol/L;③Fe(OH)3胶体具有吸附性;(3)电解制取的锌中会含有铜等杂质; (4)H2SO4、ZnSO4。 |
试题分析:(1)根据题给信息知,酸浸时ZnFe2O4会生成两种盐硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁和水,化学方程式为:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①亚铁离子被双氧水氧化成铁离子,离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O;②氢氧化铁的溶度积 Ksp[Fe( OH)3=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=4.0×10-38/(1×10-11)3=4.0×10-5mol/L;③由于生成的Fe(OH)3胶体具有吸附性,所以净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质;(3)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,反应后溶液中存在铜离子等杂质,没有净化Ⅱ操作,电解制取的锌中会含有铜等杂质;(4)通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有H2SO4、ZnSO4。 |
相似问题
要使工业废水中的重金属离子Pb2+沉淀 可用硫酸盐 碳酸盐 硫化物等作沉淀剂。已知Pb2+与这些离子
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。已知Pb2+与这些离子形成的化合物的溶解度如下表:化合物PbSO4PbCO3PbS溶
A B C D四种无色溶液 它们分别是CH3COONa溶液 NH4Cl溶液 NaHSO4溶液和BaC
A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、NaHSO4溶液和BaCl2溶液中的一种,已知A、B溶液的pH相同,A、C混合后溶液变浑浊。下列说法
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数 设计了如图装置。实验时按如下步骤操作
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:A.连接全部仪器,使其成为如图装置,并检查装置的气
(1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq) 其Ksp=____________。(
(1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq),其Ksp=____________。(2)下列说法不正确的是__________。A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;B.物
下列说法正确的是[ ]A.最外层只有1个电子的原子(除氢外)的元素的最高价氧化物对应的水化物
下列说法正确的是[ ]A.最外层只有1个电子的原子(除氢外)的元素的最高价氧化物对应的水化物一定是强碱B.若X原子的质子数是a,中子数是b,则该核素可












