工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数 设计了如图装置。实验时按如下步骤操作
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。 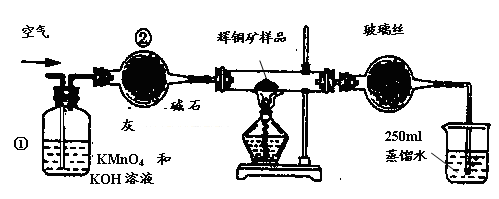 试回答下列问题: (1)装置①的作用是_________________;装置②的作用是____________________。 (2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。 (3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种既可)。 (5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。 | ||||||||||||||||||||||
参考解答
| (1)除去空气中的还原性气体与酸性气体; 干燥空气 (2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O 滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色 (3)80% (4)在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低 (5)4 ×10-3mol/L |
试题分析:(1)装置①溶液含有KMnO4具有氧化性,可吸收空气中的还原性气体,NaOH可吸收酸性气体;装置②含有碱石灰,具有吸水性,可干燥空气。 (2)操作F中KMnO4氧化H2SO4,配平可得化学方程式:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;滴定达到终点时,H2SO3完全反应,所以现象为:滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色。 (3)三次滴定标准液的体积分别为:19.99mL、20.01mL、18.04mL,第三次滴定的体积差别较大,数据出现了错误,应舍去,前两次滴定标准液的平均体积为20.00mL,根据化学方程式可得物质的对应关系为:5Cu2S ~ 5SO2~ 5H2SO3~ 2KMnO4,则辉铜矿样品中Cu2S的质量分数='0.02L×0.0100mol/L×5/2×10×160g/mol÷1.000g×100%' =80% (4)SO2能被空气中的O2氧化,所以在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低。 (5)(Fe2+)为 lmol/L,则c(S2-) = Ksp(FeS)÷c(Fe2+)=' 6' . 25 × 10 -18÷1='6' . 25 × 10 -18,带入c2 (H+) ·c(S2-) =' 1' . 0×10-22,可得c(H+)='4' ×10-3mol/L |
相似问题
(1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq) 其Ksp=____________。(
(1)对于Ag2S(s) 2Ag+(aq)+ S2-(aq),其Ksp=____________。(2)下列说法不正确的是__________。A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;B.物
下列说法正确的是[ ]A.最外层只有1个电子的原子(除氢外)的元素的最高价氧化物对应的水化物
下列说法正确的是[ ]A.最外层只有1个电子的原子(除氢外)的元素的最高价氧化物对应的水化物一定是强碱B.若X原子的质子数是a,中子数是b,则该核素可
在25℃时 AgX AgY AgZ均难溶于水 且Ksp(AgX) = 1.8×10-10 Ksp(A
在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1 8×10-10,Ksp(AgY) = 1 0×10-12,Ksp(AgZ) = 8 7×10-17。下列说法(均在25℃)错误的是A
常温时 以下4种溶液pH最大的是[ ]A.0.01mol·L-1氨水溶液 B.0.02mol
常温时,以下4种溶液pH最大的是[ ]A.0.01mol·L-1氨水溶液 B.0.02mol·L-1氨水与0.02mol·L-1盐酸溶液等体积混合液C.0.03mol·L-1氨水与0.
已知Ksp(AgCl)=1.56×10-10 Ksp(AgBr)=7.7×10-13 Ksp(Ag
已知Ksp(AgCl)=1 56×10-10,Ksp(AgBr)=7 7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0 010mol L,向该溶液中逐












