已知电极材料:铁 铜 银 石墨 锌 铝;电解质溶液:溶液 溶液 盐酸。按要求回答下列问题:(1)电工
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: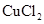 溶液、 溶液、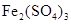 溶液、盐酸。按要求回答下列问题: 溶液、盐酸。按要求回答下列问题:(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因 (2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池 ,若能,请写出电极反应式,负极 ,正极 。(若不能,后两空不填) (3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池的正负极) |
参考解答
(1) 略(2) 能 (负极)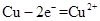 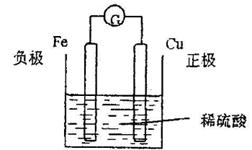 (正极) 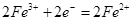 (3)(电极材料、电池的正负、闭合电路) |
试题分析:(1)铜铝的电位不同,铜铝接触的部分会由于原电池反应加速铝线的氧化,时间久了铜铝接头处会接触不良;铝和铜相比,铝比较活泼,两种电缆连接,会加速铝氧化(也就是生锈),影响使用;在铜线和铝线连接处所生成的灰白色物质系三氧化二铝,时间稍长,连接处接触电阻会增大、发热,造成电路时通时断极易引发建筑物火灾。 (2)有导电性质不同的两极及电解质溶液,故能构成原电池。原电池的正极发生还原反应,负极发生氧化反应。 点评:此题考核了有关原电池的原理,答题要求联系实际,结合原电池构成的三大要素电极材料、电池的正负、闭合电路,难度不大。 |
相似问题
将铜片与锌片用导线连接入插入稀硫酸中 锌片是( )A.阴极B.阳极C.正极D.负极
将铜片与锌片用导线连接入插入稀硫酸中,锌片是()A.阴极B.阳极C.正极D.负极
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:(1)电极X的材料是________;电解质溶液Y是__________
某学生欲完成2HCl+Cu===CuCl2+H2↑反应 设计了如图所示的四个实验 可行的实验是
某学生欲完成2HCl+Cu===CuCl2+H2↑反应,设计了如图所示的四个实验,可行的实验是
银锌蓄电池是一种高能电池 它的两极材料分别为锌和氧化银 电解质溶液为KOH溶液 放电时它的正 负两极
银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下: Ag2O+H2O+2e-=2Ag+2OH-
钢铁发生吸氧腐蚀时 正极上发生的电极反应为( ) A.2H++2e—→H2↑B.Fe2++2
钢铁发生吸氧腐蚀时,正极上发生的电极反应为() A.2H++2e—→H2↑B.Fe2++2e—→FeC.2H2O+O2+4e—→4OH—D.Fe3++e—→Fe2+












