某活动课程小组拟用50mL NaOH溶液吸收CO2气体 制备Na2CO3溶液.为了防止通入过量的CO
| 某活动课程小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤: a.取25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解; b.小火煮沸溶液1~2min,赶走溶解在溶液中的CO2气体; c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应. (1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式______.此方案第一步的实验装置如下图所示: 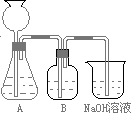 (2)加入反应物前,如何检验整个装置的气密性:______ (3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用是______ (4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置. ①HCl ②H2 ③Cl2 ④NH3 (5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为______ mol/L. |
参考解答
| (1)碳酸氢钠能和氢氧化钠反应生成碳酸钠和水,反应离子方程式为HCO3-+OH-═CO32-+H2O. 故答案为:HCO3-+OH-═CO32-+H2O. (2)用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,在装置内密封气体,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气. 故答案为:用止水夹夹住B、与烧杯之间的乳胶管,然后从漏斗中注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一段时间,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气. (3)盐酸易挥发,制取的二氧化碳含有HCl,B中盛放饱和碳酸氢钠溶液,吸收HCl气体,同时生成二氧化碳. 故答案为:饱和碳酸氢钠溶液;吸收HCl气体. (4)该制取装置适合不加热制取气体,HCl、Cl2、NH3的制备都需要加热,不能使用该装置制备,制取H2不需要加热,可以选用该装置. 故答案为:②. (5)m(NaOH)=50mL×1.44g/mL×40%=28.8g,所以n(NaOH)=
故答案为:7.2 mol/L. |
相似问题
乙烷中混有少量乙烯气体 欲除去乙烯可选用的试剂是( )A.氢氧化钠溶液B.酸性高锰酸钾溶液 氢氧化
乙烷中混有少量乙烯气体,欲除去乙烯可选用的试剂是( )A.氢氧化钠溶液B.酸性高锰酸钾溶液、氢氧化钠溶液C.溴水D.碳酸钠溶液
某溶液中含有较多的Na2SO4和少量的 Fe2(SO4)3.若用该溶液制取芒硝(Na2SO4?10H
某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3.若用该溶液制取芒硝(Na2SO4?10H2O),可供选择的操作有:①加适量H2SO4溶液;②加金属钠;③结晶;④加
有六种无色试剂:C2H5OH NaOH(aq) C6H5OH(aq) AgNO3(aq) C6H6
有六种无色试剂:C2H5OH、NaOH(aq)、C6H5OH(aq)、AgNO3(aq)、C6H6、C6H5NO2,可将它们一一鉴别出来的是( )A.氯化铁溶液B.高锰酸钾溶液C.新
某学生鉴定甲盐的发如图所示:下列结论正确的是( )A.甲中一定有Fe3+B.丙中一定有Fe3+C.
某学生鉴定甲盐的发如图所示:下列结论正确的是( )A.甲中一定有Fe3+B.丙中一定有Fe3+C.乙为AgI沉淀D.甲一定为FeBr2溶液
锗(Ge)是第ⅣA族元素 它的单质是一种良好的半导体材料 被广泛地应用在电子工业上 锗可以从烟道灰中
锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下:(1)写出上述各步反应的化学












