锗(Ge)是第ⅣA族元素 它的单质是一种良好的半导体材料 被广泛地应用在电子工业上 锗可以从烟道灰中
锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下: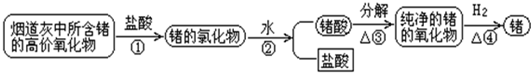 (1)写出上述各步反应的化学方程式①______;②______;③______;④______. (2)提取过程中①至③的作用是什么?从节约资源角度考虑哪一步的产物可以循环使用? |
参考解答
| (1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧化物为GeO2,与HCl(aq)发生复分解反应,生成的氯化物应为GeCl4和H2O,反应方程式为:GeO2+4HCl═GeCl4+2H2O. 故答案为:GeO2+4HCl═GeCl4+2H2O. ②GeCl4水解反应:GeCl4+4H2O  Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,原锗酸H4GeO4失水变为锗酸H2GeO3,反应方程式为GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl ) 故答案为:GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl ). ③GeCl4水解反应:GeCl4+4H2O  Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,加热平衡向右移动,HCl逸出,且水分不断蒸发,原锗酸H4GeO4失水变为锗酸H2GeO3,H4GeO4失水变为锗酸H2GeO3,锗酸受热分解为GeO2. 锗酸受热分解为GeO2与水,反应方程式为H2GeO3
故答案为:H2GeO3
④GeO2与H2发生氧化还原反应,H2夺去GeO2中的O生成H2O,Ge被还原出来.反应方程式为GeO2+2H2
故答案为:GeO2+2H2
(2)前三步的主要作用是分离、提纯和富集锗的氧化物. 第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用. 故答案为:前三步的主要作用是分离、提纯和富集锗的氧化物. 第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用. |
相似问题
从下列事实所得出的相应结论正确的为( )实 验 事 实结 论①Cl2的水溶液可以
从下列事实所得出的相应结论正确的为( )实验事实结论①Cl2的水溶液可以导电Cl2是电解质②将CO2通入到Na2SiO3溶液中产生白色浑浊酸性:H2CO3>H2SiO3
碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案 其流程图如下.(所用石灰石含有杂质SiO
碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下.(所用石灰石含有杂质SiO2)回答下列问题:(1)充分煅烧110吨石灰石得到
某课外活动小组设计如图实验装置 验证“二氧化碳与水接触时才能和过氧化钠反应”.(1)过氧化钠与二氧化
某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.(1)过氧化钠与二氧化碳反应的化学方程式是______,该反应中,反应物
课题式课堂活动式研究是研究性学习的一种方式 其基本活动模式为:下面是关于“一氧化碳的化学性质”的课题
课题式课堂活动式研究是研究性学习的一种方式,其基本活动模式为:下面是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段甲同学设计的证明一
下列有关物质检验的实验结论正确的是( )选项实验操作及现象实验结论A向某溶液中加入盐酸酸化的氯化钡
下列有关物质检验的实验结论正确的是( )选项实验操作及现象实验结论A向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成该溶液中一定含有SO42-B向












