工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H20(g)═C0(g)+3H2(g)△H
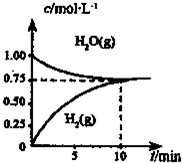
| 工业上制备合成气的工艺主要是水蒸气重整甲烷: CH4(g)+H20(g)═C0(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1molCH4(g)和1molH20(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如右图所示,下列说法正确的是( )
 |
参考解答
A.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CH4)=
B.由图可知,10min到达平衡,平衡时H2的浓度变化量为0.75mol/L,浓度变化量之比等于化学计量数之比,故△c(CO)=
C.平衡时H2的浓度变化量为0.75mol/L,则: CH4(g)+H20(g)═C0(g)+3H2(g) 开始(mol/L):1 1 0 0 变化(mol/L):0.25 0.250.250.75 平衡(mol/L):0.75 0.75 0.25 0.75 故该温度下平衡常数k=
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡状态,当CH4(g)的消耗速率与H20(g)的生成速率相等,等于化学计量数之比,说明到达平衡,故D正确; 故选D. |
相似问题
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?12N2(g)+CO2(g)△H=-373.4
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?12N2(g)+CO2(g)△H=-373 4kJ?mol-1.在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意
在一定温度下 可逆反应X(g) + 3Y(g)2Z(g)达到平衡的标志是[ ]A.Z生成的速
在一定温度下,可逆反应X(g) + 3Y(g)2Z(g)达到平衡的标志是[ ]A.Z生成的速率与X生成的速率相等 B.单位时间生成a mol X,同时生成3a mol Y
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时 在容积固定的容器中发生反应 各物质
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分
有一化学平衡mA(g)+nB(g)?PC(g)+qD(g) 右图表示A的转化率与压强 温度的关系.由
有一化学平衡mA(g)+nB(g)?PC(g)+qD(g),右图表示A的转化率与压强、温度的关系.由此得出的正确结论是( )A.正反应是吸热反应B.(m+n)<(
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g).某化学兴趣小组的同学根据此反应在不同条
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g).某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,ω(W)表示W在












