已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时 在容积固定的容器中发生反应 各物质
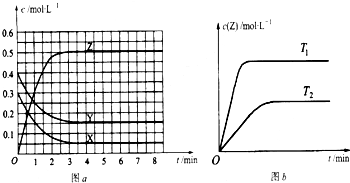
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
 |
参考解答
| 由图a可知,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,化学计量数之比等于物质的量变化量之比,故反应为X(g)+Y(g)?2Z(g);由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应. A、由上述分析可知反应为X(g)+Y(g)?2Z(g),速率之比等于物质的量变化量之比,所以反应时各物质的反应速率大小关系为:2v(X)=2v(Y)=v(Z),故A正确; B、由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,所以Y的转化率为
C、由图a可知,温度为T0达平衡时,X、Y、Z的物质的量浓度分别为0.05mol/L、0.15mol/L、0.5mol/L,反应为X(g)+Y(g)?2Z(g)的平衡常数k=
D、由上述分析可知,该反应正反应为吸热反应,故D错误. 故选:AC. |
相似问题
有一化学平衡mA(g)+nB(g)?PC(g)+qD(g) 右图表示A的转化率与压强 温度的关系.由
有一化学平衡mA(g)+nB(g)?PC(g)+qD(g),右图表示A的转化率与压强、温度的关系.由此得出的正确结论是( )A.正反应是吸热反应B.(m+n)<(
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g).某化学兴趣小组的同学根据此反应在不同条
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g).某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,ω(W)表示W在
在一定温度下 下列叙述不是可逆反应A(g)+3B(g)2C(g)达到平衡的标志的是 [ ]①
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)2C(g)达到平衡的标志的是 [ ]①C的生成速率与C的分解速率相等;②混合气体的总压强不再变化;③A、B、C
氮是一种地球上含量丰富的元素 氮及其化合物的研究在生产 生活中有着重要意义。 (1)下图是1 mol
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。 (1)下图是1 molNO2和l mol CO反应生成CO2和NO过程中能量变化示意图
在一定温度下 容器内某一反应中M N的物质的量随反应时间变化的曲线如图 下列表述中正确的是[
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是[ ]A.反应的化学方程式为:2MN B.t2时,正逆反应速率相












