T℃时 有甲 乙两个密闭容器 甲容器的体积为1 L 乙容器的体积为2 L 分别向甲 乙两容器中加入6
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g)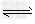 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题: 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题: (1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________. (2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”),原因是______________________________. (3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________. (4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________. A.保持温度不变,增大甲容器的体积至2 L B.保持容器体积不变,使甲容器升高温度 C.保持容器压强和温度都不变,向甲中加入一定量的A气体 D.保持容器压强和温度都不变,向甲中加入一定量的B气体 (5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________. |
参考解答
| (1)0.3 mol/(L·min) ;1 (2)大于 ;乙容器的体积大于甲容器的体积,浓度减小 ,反应速率减慢,达平衡所需时间长 (3)3 mol ;2 mol (4)AC (5) 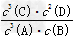 ;10.8 mol/L ;10.8 mol/L |
相似问题
在一固定体积的密闭容器中加入2molA和1molB发生反应:2A(g)+B(g)?3C(g)+D(g
在一固定体积的密闭容器中加入2molA和1molB发生反应:2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为wmol?L-1,若维持容器的体积和温度不变,按下
CO(g)+H2O(g)CO2(g)+H2(g)△H<0在温度t1时达到平衡 c1(CO)=c1(H
CO(g)+H2O(g)CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1 0mol L,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓
由碳的氧化物直接合成乙醇燃料已进入大规模生产.下图是由二氧化碳合成乙醇的技术流程:吸收池中盛有饱和碳
由碳的氧化物直接合成乙醇燃料已进入大规模生产.下图是由二氧化碳合成乙醇的技术流程:吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中
甲醇是一种可再生能源 具有广泛的开发和应用前景。 (1)工业上一般采用下列两种反应合成甲醇:反应I:
甲醇是一种可再生能源,具有广泛的开发和应用前景。 (1)工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)CH3OH(g) △H1 反应Ⅱ:CO2(g) +3H
某温度下 反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K 下列说法正确的是[
某温度下,反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法正确的是[ ]A K越大,达到平衡时,反应进行的程度越小B K越小,达到平衡时,反应物的转化












