(10分)已知醋酸和盐酸是日常生活中极为常见的酸 在一定条件下 CH3COOH溶液中存在电离平衡:C
(10分)已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH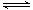 CH3COO-+H+ ΔH>0。 CH3COO-+H+ ΔH>0。(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=_________(填数字表达式)。 下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是____(填字母)。 a.加入少量0.10 mol·L-1的稀盐酸 b.加热 c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液 (2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸______V醋酸 ,(填“>”、“<”或“=”下同),反应的最初速率为:υ盐酸_______υ醋酸。 (3)常温下,向体积为Va mL,pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:_____________;溶液中各离子的浓度按照由大到小排序为_______。 |
参考解答
| (1)(10-5-10-9)mol/L b、c、f (2)< = (3)Va < Vb c(Na+) = c(CH3COO-) > c(H+) = c(OH-) |
(1)在醋酸溶液中其电荷守恒为: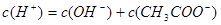 ,由于pH =5即 ,由于pH =5即 ,所以可得c(CH3COO-)=(10-5-10-9)mol/L;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是:因电离是吸热反应加热电离程度增大;稀释电离程度增大;加入少量0.10 mol·L-1的NaOH溶液能与氢离子反应使醋酸的电离程度增大; ,所以可得c(CH3COO-)=(10-5-10-9)mol/L;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是:因电离是吸热反应加热电离程度增大;稀释电离程度增大;加入少量0.10 mol·L-1的NaOH溶液能与氢离子反应使醋酸的电离程度增大;(2)等体积且pH均等于3的醋酸和盐酸溶液中,因醋酸是弱酸,所以醋酸的物质的量更大,所以生成氢气的体积:V盐酸小于V醋酸 , 应的最初速率为:υ盐酸=υ醋酸。 (3)若两都等体积反应,则醋酸过量溶液显酸性,而现要使溶液显中性,即Va < Vb;溶液中各离子的浓度按照由大到小排序为c(Na+) = c(CH3COO-) > c(H+) = c(OH-); |
相似问题
(12分) 常温下 向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-
(12分) 常温下,向100 mL 0 01 mol·L-1HA溶液中逐滴加入0 02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回
常温下 pH=2的NaOH溶液与pH=1的HC1溶液按一定比例混合 所得溶液pH=2 则NaOH溶液
常温下,pH=2的NaOH溶液与pH=1的HC1溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HC1溶液的体积比为A.9:2B.2:9C.1:9D.10:1
20℃时H2S饱溶液1L 其浓度为0.1mol·L-1 其电离方程式为H2SH++HS- HS-H+
20℃时H2S饱溶液1L,其浓度为0 1mol·L-1,其电离方程式为H2SH++HS-,HS-H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是A.加入适量的水B.加入
氨气溶于水时 大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可
氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )A.B.C.D.
下列对于溶液中的问题叙述正确的是A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小B.Na
下列对于溶液中的问题叙述正确的是A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小B.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小C.












