(12分) 常温下 向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-
(12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: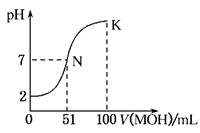 (1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分) (2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分) (3)请写出K点所对应的溶液中离子浓度的大小关系:__________ (2分) (4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分) |
参考解答
| (1)强 0.01 mol·L-1HA的pH为2,说明HA完全电离 (2)< M++H2OMOH+H+,1×10-amol·L-1,(3)c(M+)>c(A-)>c(OH-)>c(H+),(4)= 0.005 |
此题为关于溶解度曲线的题目,首先要看清曲线:起点(强酸弱酸、强碱弱碱),曲线平滑、滴定终点、pH=7的点等等。(1)因为浓度0.01mol/L,pH=2,故该酸为一元强酸;(2)V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)> 2c(A-) MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)> 2c(A-) |
相似问题
常温下 pH=2的NaOH溶液与pH=1的HC1溶液按一定比例混合 所得溶液pH=2 则NaOH溶液
常温下,pH=2的NaOH溶液与pH=1的HC1溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HC1溶液的体积比为A.9:2B.2:9C.1:9D.10:1
20℃时H2S饱溶液1L 其浓度为0.1mol·L-1 其电离方程式为H2SH++HS- HS-H+
20℃时H2S饱溶液1L,其浓度为0 1mol·L-1,其电离方程式为H2SH++HS-,HS-H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是A.加入适量的水B.加入
氨气溶于水时 大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可
氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )A.B.C.D.
下列对于溶液中的问题叙述正确的是A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小B.Na
下列对于溶液中的问题叙述正确的是A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小B.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小C.
在电解水制取H2和O2时 为了增强溶液的导电性 常加入一些电解质。下列物质中最合适的是A.Na2SO
在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质。下列物质中最合适的是A.Na2SO4 B.CuC12 C.NaCl D.AgNO3












